一种有机硒化合物的合成方法
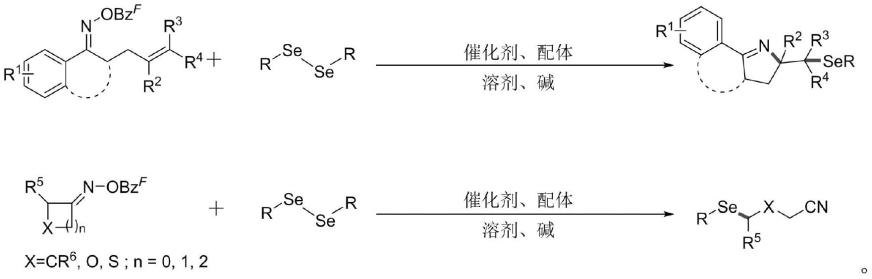
1.本发明属于合成药物化学技术领域,涉及一种有机硒化合物的合成方法,具体涉及一种有机硒吡咯啉衍生物与有机硒烷基腈衍生物的合成方法。
背景技术:
2.硒元素作为人体内必需的微量元素之一,在身体的日常代谢中起到抗氧化以及提高身体免疫力的作用,且不会在身体里堆积,因此科学补硒成了人们拥有健康、美好生活的手段。同时在生物医药领域硒元素也被证明是抗癌、抗肿瘤、抗炎的有力帮手。除了在医药行业里被广泛使用以外,硒也被其他行业广泛使用。如硒合金在电子行业可用作感光器、光电池,硫硒化镉在化工颜料行业可用作催化剂、抗氧化剂,有机硒化合物在化妆品行业可用作抗衰老剂和抗氧化剂,天然有机硒化合物在保健食品业可用作食品添加剂。目前关于有机硒的化学合成方法不多,有机硒化合物的种类较少。因此开发通用且实用的新方法来构建c-se键,拓展有机硒化合物的种类是非常重要的一个步骤。
3.通常人们对c-se键的构建通过卤化物或硼酸与硒醇或二硒化物的交叉偶联。此类方法合成的脂肪族硒化合物易挥发、不稳定、且后处理困难。因此在工业应用上受到了一定限制。近年用过渡金属催化的肟酯末端烯烃1,2氨基芳基化的反应与环酮肟酯类衍生物的开环官能化受到了大家的关注和研究。这种方式条件温和,底物普适性强,转化率高,绿色安全,但是利用该路线合成有机硒类化合物的方法存在技术空白的问题。另外,由于有机硒吡咯啉衍生物与有机硒烷基腈衍生物的合成目前只能利用光催化来实现,且光催化的工业化目前存在技术壁垒,而传统的过渡金属催化的工业化路线更加成熟。因此利用过渡金属催化合成有机硒类化合物的方法具有实际的应用价值。
技术实现要素:
4.有鉴于此,本发明的目的是针对现有技术中存在的问题,提供一种有机硒化合物的合成方法。
5.本发明具体公开了一种有机硒吡咯啉衍生物与有机硒烷基腈衍生物的合成方法,通过以廉价易得的过渡金属作为反应的催化剂,用二硒化物作为硒化试剂,与γ,δ-不饱和肟酯和环酮肟酯进行硒化反应得到其对应的有机硒产物,不仅官能团兼容范围较广,且该方法中催化剂廉价易得,反应条件温和,收率高,重现性好。
6.为了实现上述目的,本发明采用如下技术方案:
7.一种有机硒化合物的合成方法,所述方法具体包括如下步骤:
8.(1)向25毫升的史莱克管中加入催化剂、配体和有机溶剂,搅拌得反应溶剂,备用;
9.(2)待步骤(1)反应溶剂冷却至室温后,继续向25毫升的史莱克管中添加肟酯、二硒化物和碱反应;并于反应过程中用tlc进行跟踪以决定具体的反应时间;
10.(3)待步骤(2)的反应结束后,将溶剂旋干,并用硅胶柱进行纯化得到所述有机硒化合物,即为有机硒吡咯啉衍生物与有机硒烷基腈衍生物。
11.合成路线为:
[0012][0013]
其中,r、r1、r2、r3、r4、r5、r6至少选自氢、烷基、杂环、卤素、芳基、取代芳基、酯基中的一种;r3和r4相同或不同。
[0014]
进一步的,步骤(1)中的搅拌温度为80℃,搅拌时间为30min;步骤(2)中的反应温度为90℃,反应时间为12-24h。
[0015]
进一步的,所述肟酯在反应溶剂中的摩尔浓度为0.2~1.0mmol/ml,及所述有机溶剂为1,4-二氧六环、甲苯、四氢呋喃、二氯甲烷、乙腈、环己烷、n,n-二甲基甲酰胺、二甲基亚砜、乙酸乙酯或n-甲基吡咯烷酮,且所述有机溶剂的用量为2-8ml。
[0016]
进一步的,所述催化剂为双-(1,5-环辛二烯镍)或氯化亚铁,及所述催化剂的用量为肟酯用量的5mol%~30mol%;所述配体为含氮双齿配体,具体包括2,2'-联吡啶、4,4'-二叔丁基-2,2'-联吡啶、4,4'-二甲氧基-2,2'-联吡啶、1,10-菲罗啉、3,4,7,8-四甲基-1,10-菲罗啉、4,7-二苯基-1,10-菲罗啉或4,7-二甲氧基-1,10-菲咯啉,且所述配体用量为肟酯用量的5mol%-30mol%。
[0017]
进一步的,所述碱为有机或无机碱,包括三乙胺、二异丙基乙基胺、四甲基乙基胺、叔丁醇钾、碳酸铯、碳酸钾、碳酸钠或氢氧化钠,碱的用量为肟酯用量的1e-15e;所述硒化试剂为芳基二硒醚或烷基二硒醚,及肟酯与硒化试剂的摩尔比为2:1~1:2。
[0018]
进一步的,所述步骤3)中的处理及纯化方法:先将反应后的溶剂旋干,进一步用柱层析法纯化分离;
[0019]
其中,柱层析可以选择200~300目的硅胶作为固定相,展开剂为石油醚和乙酸乙酯的混合溶液。
[0020]
与现有技术相比,本发明优点在于:产率高,反应条件相对温和,催化剂廉价易得,环保安全,重现性好,更加具有工业化应用潜力,该技术填补了多种有机硒吡咯啉衍生物与有机硒烷基腈衍生物合成路线的技术空白。
附图说明
[0021]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图
[0022]
图1为实施例3的谱图。
[0023]
图2为实施例5的谱图。
[0024]
图3为实施例13的谱图。
[0025]
图4为实施例25的谱图。
[0026]
图5为实施例26的谱图。
具体实施方式
[0027]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0028]
为更好地理解本发明,下面通过以下实施例对本发明作进一步具体的阐述,但不可理解为对本发明的限定,对于本领域的技术人员根据上述发明内容所作的一些非本质的改进与调整,也视为落在本发明的保护范围内。
[0029]
实施例1:5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯的制备
[0030]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-苯基戊-4-烯-1-酮o-全氟苯甲酰肟(73.8mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯(56.9mg)产率90%。
[0031][0032]
5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯
[0033]1h nmr(400mhz,chloroform-d)δ7.84
–
7.75(m,2h),7.60
–
7.52(m,2h),7.41(dd,j=9.1,6.9hz,3h),7.24(d,j=6.8hz,3h),4.58
–
4.47(m,1h),3.47(dd,j=12.0,4.7hz,1h),3.09(dd,j=12.1,7.9hz,2h),2.99
–
2.85(m,1h),2.29(dt,j=8.0,2.5hz,1h),1.88
–
1.74(m,1h);
13
c nmr(101mhz,chloroform-d)δ173.52,134.41,132.70,130.70,129.13,128.52,127.91,126.86,125.90,72.96,35.48,34.47,28.70.
[0034]
实施例2:5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯的制备
[0035]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-苯基戊-4-烯-1-酮o-全氟苯甲酰肟(73.8mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯(50.4mg)产率80%。
[0036]
[0037]
5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯
[0038]1h nmr(400mhz,chloroform-d)δ7.84
–
7.75(m,2h),7.60
–
7.52(m,2h),7.41(dd,j=9.1,6.9hz,3h),7.24(d,j=6.8hz,3h),4.58
–
4.47(m,1h),3.47(dd,j=12.0,4.7hz,1h),3.09(dd,j=12.1,7.9hz,2h),2.99
–
2.85(m,1h),2.29(dt,j=8.0,2.5hz,1h),1.88
–
1.74(m,1h);
13
c nmr(101mhz,chloroform-d)δ173.52,134.41,132.70,130.70,129.13,128.52,127.91,126.86,125.90,72.96,35.48,34.47,28.70.
[0039]
实施例3:5-(4-氯苯基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯的制备
[0040]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-(4-氯苯基)戊-4-烯-1-酮o-全氟苯甲酰肟(80.6mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-(4-氯苯基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯(46.1mg)产率66%。
[0041][0042]
5-(4-氯苯基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯
[0043]1h nmr(400mhz,chloroform-d)δ7.72(d,j=8.6hz,2h),7.54(dd,j=7.6,1.9hz,2h),7.36(d,j=8.6hz,2h),7.25
–
7.18(m,3h),4.52(s,1h),3.43(dd,j=12.1,4.8hz,1h),3.17
–
2.98(m,2h),2.96
–
2.82(m,1h),2.36
–
2.22(m,1h),1.88
–
1.74(m,1h);
13
c nmr(151mhz,chloroform-d)δ172.38,136.76,132.91,132.73,130.63,129.24,129.17,128.77,126.93,73.12,35.51,34.47,28.79;hrms(esi):m/z calcd for c
17h16
clnse[m+h]
+
350.0214,found 350.0214.
[0044]
实施例4:5-(4-甲氧基苯基)-2-((苯基己烯基)甲基)-3,4-二氢-2h-吡咯的制备
[0045]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-(4-甲氧基苯基)戊-4-烯-1-酮o-全氟苯甲酰肟(79.8mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-(4-甲氧基苯基)-2-((苯基己烯基)甲基)-3,4-二氢-2h-吡咯(56.0mg)产率81%。
[0046][0047]
5-(4-甲氧基苯基)-2-((苯基己烯基)甲基)-3,4-二氢-2h-吡咯
[0048]1h nmr(400mhz,chloroform-d)δ7.75(d,j=8.8hz,2h),7.55(d,j=7.9hz,2h),7.23(d,j=7.1hz,3h),6.90(d,j=8.8hz,2h),4.54
–
4.43(m,1h),3.84(s,3h),3.46(dd,j
=12.0,4.7hz,1h),3.13
–
2.98(m,2h),2.95
–
2.81(m,1h),2.32
–
2.22(m,1h),1.77(d,j=23.5hz,1h);
13
c nmr(151mhz,chloroform-d)δ172.85,161.69,132.67,130.71,129.61,129.12,127.14,126.83,113.83,72.69,55.47,35.36,34.57,28.76;hrms(esi):m/z calcd for c
18h19
nose[m+h]
+
346.0710,found 346.0711.
[0049]
实施例5:5-(3-氯苯基)-2-(苯基己烯基)甲基)-3,4-二氢-2h-吡咯的制备
[0050]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-(3-氯苯基)戊-4-烯-1-酮o-全氟苯甲酰肟(80.6mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-(3-氯苯基)-2-(苯基己烯基)甲基)-3,4-二氢-2h-吡咯(54.4mg)产率78%。
[0051][0052]
5-(3-氯苯基)-2-(苯基己烯基)甲基)-3,4-二氢-2h-吡咯
[0053]1h nmr(400mhz,chloroform-d)δ7.79(s,1h),7.63(d,j=7.7hz,1h),7.55(d,j=7.8hz,2h),7.42
–
7.18(m,5h),4.53(t,j=6.8hz,1h),3.43(dd,j=12.2,4.9hz,1h),3.18
–
2.96(m,2h),2.93
–
2.80(m,1h),2.34
–
2.21(m,1h),1.88
–
1.76(m,1h);
13
c nmr(101mhz,chloroform-d)δ172.27,136.19,134.66,132.75,130.64,130.59,129.78,129.16,127.97,126.96,126.05,73.15,35.54,34.43,28.71;hrms(esi):m/z calcd for c
17h16
clnse[m+h]
+
350.0214,found 350.0224.
[0054]
实施例6:5-(3-甲氧基苯基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯的制备
[0055]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-(3-甲氧基苯基)戊-4-烯-1-酮o-全氟苯甲酰肟(79.8mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-(3-甲氧基苯基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯(55.2mg)产率80%。
[0056][0057]
5-(3-甲氧基苯基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯
[0058]1hnmr(400mhz,chloroform-d)δ7.59
–
7.50(m,2h),7.40(s,1h),7.36
–
7.27(m,2h),7.23(d,j=6.6hz,3h),6.98(d,j=7.8hz,1h),4.58
–
4.47(m,1h),3.84(s,3h),3.47(dd,j=12.1,4.6hz,1h),3.06(t,j=12.3hz,2h),2.98
–
2.84(m,1h),2.35
–
2.22(m,1h),
1.83(d,j=16.9hz,1h);
13
c nmr(101mhz,chloroform-d)δ173.48,159.75,135.81,132.75,130.69,129.51,129.14,126.89,120.71,117.24,112.25,72.97,55.53,35.61,34.49,28.72;hrms(esi):m/z calcd for c
18h19
nose[m+h]
+
346.0710,found 346.0713.
[0059]
实施例7:2-((苯基硒基)甲基)-5-(噻吩-2-基)-3,4-二氢-2h-吡咯的制备
[0060]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-(噻吩-2-基)戊-4-烯-1-酮o-全氟苯甲酰肟(75.0mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-((苯基硒基)甲基)-5-(噻吩-2-基)-3,4-二氢-2h-吡咯(43.7mg)产率54%。
[0061][0062]
2-((苯基硒基)甲基)-5-(噻吩-2-基)-3,4-二氢-2h-吡咯
[0063]1h nmr(400mhz,chloroform-d)δ7.53
–
7.46(m,2h),7.11(dd,j=5.1,3.7hz,1h),5.83(td,j=16.9,6.7hz,1h),5.16
–
4.98(m,2h),3.01
–
2.92(m,2h),2.48
–
2.37(m,2h);
13
c nmr(151mhz,chloroform-d)δ163.27,156.35,146.50(d,j=11.3hz),144.65(d,j=44.2hz),142.81,138.74(d,j=12.9hz),137.08(d,j=28.2hz),136.21,136.14,130.43,130.17,127.70,116.40,107.01(d,j=33.8hz),31.40,28.98;hrms(esi):m/z calcd for c
15h15
nsse[m+h]
+
322.0169,found 322.0172.
[0064]
实施例8:5-(呋喃-2-基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯的制备
[0065]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-(呋喃-2-基)戊-4-烯-1-酮o-全氟苯甲酰肟(71.8mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-(呋喃-2-基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯(36.6mg)产率44%。
[0066][0067]
5-(呋喃-2-基)-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯
[0068]1h nmr(600mhz,chloroform-d)δ7.50
–
7.46(m,3h),7.17(dd,j=9.5,7.0hz,3h),6.74(d,j=3.4hz,1h),6.41(dd,j=3.5,1.7hz,1h),4.45
–
4.37(m,1h),3.47(dd,j=12.2,4.3hz,1h),2.94(dd,j=12.1,8.7hz,2h),2.76(dt,j=19.0,9.7hz,1h),2.25
–
2.17(m,1h),1.67(d,j=7.2hz,1h);
13
c nmr(151mhz,chloroform-d)δ164.10,149.87,144.86,132.57,130.45,129.17,126.89,113.65,111.71,73.10,35.30,34.01,28.48;hrms(esi):m/z calcd for c
15h15
nose[m+h]
+
306.0397,found 306.0399.
[0069]
实施例9:5-苯基-2-(1-(苯基硒基)乙基)-3,4-二氢-2h-吡咯的制备
[0070]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-苯基十六烷-4-烯-1-酮o-全氟苯甲酰肟(76.6mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-苯基-2-(1-(苯基硒基)乙基)-3,4-二氢-2h-吡咯(34.1mg)产率52%。
[0071][0072]
5-苯基-2-(1-(苯基硒基)乙基)-3,4-二氢-2h-吡咯
[0073]1h nmr(400mhz,chloroform-d)δ7.83
–
7.77(m,2h),7.60
–
7.56(m,2h),7.38(d,j=7.7hz,3h),7.23(dd,j=4.1,2.3hz,3h),4.50
–
4.40(m,1h),3.85
–
3.74(m,1h),3.11
–
2.83(m,2h),2.22
–
2.09(m,1h),1.95(d,j=10.3hz,1h),1.38(d,j=7.0hz,3h);
13
c nmr(101mhz,chloroform-d)δ173.55,134.57,134.51,130.66,129.88,129.10,128.54,127.91,127.39,77.30,44.39,35.76,25.17,17.50;hrms(esi):m/z calcd for c
18h19
nse[m+h]
+
330.0761,found 330.0765.
[0074]
实施例10:5-苯基-2-(2-(苯基硒基)丙-2-基)-3,4-二氢-2h-吡咯的制备
[0075]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入5-甲基-1-苯基十六烷-4-烯-1-酮o-全氟苯甲酰肟(76.4mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-苯基-2-(2-(苯基硒基)丙-2-基)-3,4-二氢-2h-吡咯(48.0mg)产率70%。
[0076][0077]
5-苯基-2-(2-(苯基硒基)丙-2-基)-3,4-二氢-2h-吡咯
[0078]1h nmr(400mhz,chloroform-d)δ7.69(dd,j=7.7,1.9hz,2h),7.56
–
7.48(m,2h),7.35
–
7.16(m,4h),7.15
–
7.02(m,2h),4.18
–
4.08(m,1h),2.95
–
2.71(m,2h),2.11
–
1.86(m,2h),1.36(s,3h),1.26(s,3h);
13
c nmr(101mhz,chloroform-d)δ173.13,138.61,134.70,130.50,128.74
–
128.35(m),127.85(d,j=13.6hz),82.52,51.92,35.59,28.31,26.37,25.55.
[0079]
实施例11:2-甲基-5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯的制备
[0080]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下
加入4-甲基-1-苯基戊-4-烯-1-酮o-全氟苯甲酰肟(76.6mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-甲基-5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯(34.9mg)产率53%。
[0081][0082]
2-甲基-5-苯基-2-((苯基硒基)甲基)-3,4-二氢-2h-吡咯
[0083]1h nmr(400mhz,chloroform-d)δ7.85
–
7.77(m,2h),7.55(dd,j=7.6,2.0hz,2h),7.42(dd,j=9.3,7.1hz,3h),7.23(q,j=5.1hz,3h),3.35(d,j=10.4hz,2h),3.09(t,j=8.0hz,2h),2.16(dt,j=12.9,8.1hz,1h),1.97
–
1.84(m,1h),1.49(s,3h);
13
c nmr(101mhz,chloroform-d)δ171.38,134.54,132.42,131.76,130.54,129.04,128.44,127.93,126.62,76.92,41.55,35.97,34.08,27.83;hrms(esi):m/z calcd for c
18h19
nse[m+h]
+
330.0761,found 330.0767.
[0084]
实施例12:2-((苯基硒基)甲基)-3,3a,4,5-四氢-2h-苯并(g)吲哚的制备
[0085]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入2-烯丙基-3,4-二氢萘-1(2h)-酮-o-全氟苯甲酰肟(79.0mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-((苯基硒基)甲基)-3,3a,4,5-四氢-2h-苯并(g)吲哚(34.8mg)产率51%。
[0086][0087]
2-((苯基硒基)甲基)-3,3a,4,5-四氢-2h-苯并(g)吲哚
[0088]
(obtained in a 2.2:1ratio of diastereomers,data are given for the mixture);1h nmr(400mhz,chloroform-d)δ8.08(dd,j=7.7,1.4hz,2h(major isomer)),8.03(dd,j=7.9,1.4hz,1h(minor isomer)),7.65
–
7.49(m,6h(major isomer)),7.34(td,j=7.5,1.6hz,3h(minor isomer)),7.30
–
7.03(m,8h(major isomer)+4h(minor isomer)),4.64(td,j=8.6,4.2hz,1h(minor isomer)),4.28
–
4.10(m,2h(major isomer)),3.63(dd,j=11.9,4.9hz,2h(major isomer)),3.29(dd,j=12.2,4.5hz,1h(minor isomer)),3.19
–
2.76(m,8h(major isomer)+4h(minor isomer)),2.54(ddd,j=12.3,7.9,6.2hz,2h(minor isomer)),2.33
–
2.19(m,4h(major isomer)),1.79(dt,j=13.1,9.2hz,1h(minor isomer)),1.69(td,j=12.9,4.8hz,2h(major isomer)),1.65
–
1.53(m,1h(minor isomer)),1.40
–
1.23(m,2h(major isomer));
13
c nmr(101mhz,chloroform-d)δ174.59,174.12,141.21,132.60,132.56,131.56,130.98,130.95,130.66,130.61,130.04,129.96,129.28,129.13,129.10,128.95,128.90,126.85,126.79,126.54,
126.49,126.20,126.06,71.12,71.01,47.85,45.99,37.75,34.90,34.63,32.66,30.14,30.09,30.00,29.73;hrms(esi):m/z calcd for c
19h19
nse[m+h]
+
342.0761,found 342.0768.
[0089]
实施例13:2-(((4-甲氧基苯基)硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯的制备
[0090]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-苯基戊-4-烯-1-酮o-全氟苯甲酰肟(73.8mg,0.2mmol),二(4-甲氧基苯基)二硒醚(112.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-(((4-甲氧基苯基)硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯(38.2mg)产率55%。
[0091][0092]
2-(((4-甲氧基苯基)硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯
[0093]1h nmr(400mhz,chloroform-d)δ7.88
–
7.76(m,2h),7.52(d,j=8.8hz,2h),7.41(t,j=7.7hz,4h),6.79(d,j=8.7hz,2h),4.52
–
4.40(m,1h),3.78(s,3h),3.39(dd,j=12.1,4.6hz,1h),3.14
–
3.02(m,1h),3.02
–
2.84(m,2h),2.33
–
2.21(m,1h),1.85
–
1.74(m,1h);
13
c nmr(101mhz,chloroform-d)δ173.31,159.31,135.64,134.49,130.63,128.49,127.87,120.30,114.84,73.13,55.39,35.52,35.41,28.65;hrms(esi):m/z calcd for c
18h19
nose[m+h]
+
346.0710,found 346.0718.
[0094]
实施例14:2-(((4-氟苯基)硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯的制备
[0095]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-苯基戊-4-烯-1-酮o-全氟苯甲酰肟(73.8mg,0.2mmol),二(4-氟苯基)二硒醚(105.0mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-(((4-氟苯基)硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯(38.9mg)产率58%。
[0096][0097]
2-(((4-氟苯基)硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯
[0098]1h nmr(400mhz,chloroform-d)δ7.84
–
7.73(m,2h),7.54(dd,j=8.6,5.5hz,2h),7.46
–
7.36(m,3h),6.94(t,j=8.8hz,2h),4.55
–
4.43(m,1h),3.40(dd,j=12.1,4.8hz,1h),3.16
–
3.00(m,2h),2.99
–
2.86(m,1h),2.35
–
2.18(m,1h),1.86
–
1.72(m,1h);
13
c nmr(101mhz,chloroform-d)δ173.49,162.40(d,j=246.4hz),135.36(d,j=7.7hz),130.74,128.54,127.89,124.96(d,j=3.5hz),116.27(d,j=21.5hz),73.00,35.49(d,j=1.6hz),28.69;
19
f nmr(376mhz,chloroform-d)δ-115.10;hrms(esi):m/z calcd for c
17h16
fnse[m
+h]
+
334.0510,found 334.0515.
[0099]
实施例15:2-((苄基硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯的制备
[0100]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-苯基戊-4-烯-1-酮o-全氟苯甲酰肟(73.8mg,0.2mmol),二苄基二硒醚(102.6mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-((苄基硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯(48.0mg)产率73%。
[0101][0102]
2-((苄基硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯
[0103]1h nmr(400mhz,chloroform-d)δ7.85(dd,j=7.8,1.9hz,2h),7.42(d,j=2.1hz,3h),7.29(dd,j=9.2,6.7hz,4h),7.22
–
7.16(m,1h),4.57
–
4.46(m,1h),3.87(s,2h),3.12
–
3.01(m,1h),2.98
–
2.88(m,2h),2.83(dd,j=12.3,6.9hz,1h),2.29
–
2.16(m,1h),1.77
–
1.68(m,1h);
13
c nmr(101mhz,chloroform-d)δ173.22,139.76,134.53,130.66,129.15,129.06,128.59,127.89,126.75,73.54,35.53,30.73,28.80,28.12;hrms(esi):m/z calcd for c
18h19
nse[m+h]
+
330.0761,found 330.0765.
[0104]
实施例16:2-((甲基硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯的制备
[0105]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入1-苯基戊-4-烯-1-酮o-全氟苯甲酰肟(73.8mg,0.2mmol),二甲基二硒醚(57.0mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-((甲基硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯(27.1mg)产率54%。
[0106][0107]
2-((甲基硒基)甲基)-5-苯基-3,4-二氢-2h-吡咯
[0108]1h nmr(600mhz,chloroform-d)δ7.84(d,j=6.5hz,2h),7.49
–
7.37(m,3h),4.57
–
4.49(m,1h),3.13
–
3.05(m,1h),3.02(dd,j=12.4,4.8hz,1h),2.97
–
2.89(m,1h),2.80(dd,j=12.4,7.4hz,1h),2.33
–
2.22(m,1h),2.06(s,3h),1.84
–
1.75(m,1h);
13
c nmr(151mhz,chloroform-d)δ173.26,134.46,130.68,128.56,127.88,73.41,35.45,32.25,28.66,5.41;hrms(esi):m/z calcd for c
12h15
nse[m+h]
+
254.0448,found 254.0450.
[0109]
实施例17:4-(苯基硒基)丁腈的制备
[0110]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入环丁酮o-全氟苯甲酰肟(55.8mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺
(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到4-(苯基硒基)丁腈(46.4mg)产率86%。
[0111][0112]
4-(苯基硒基)丁腈
[0113]1h nmr(400mhz,chloroform-d)δ7.55
–
7.46(m,2h),7.34
–
7.24(m,3h),2.99(t,j=7.0hz,2h),2.49(t,j=7.0hz,2h),2.07
–
1.93(m,2h);
13
c nmr(101mhz,chloroform-d)δ133.35,129.43,128.82,127.63,119.16,26.16,25.82,17.13.
[0114]
实施例18:4-(苯基硒基)丁腈的制备
[0115]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入环丁酮o-全氟苯甲酰肟(55.8mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到4-(苯基硒基)丁腈(44.1mg)产率98%。
[0116][0117]
4-(苯基硒基)丁腈
[0118]1h nmr(400mhz,chloroform-d)δ7.55
–
7.46(m,2h),7.34
–
7.24(m,3h),2.99(t,j=7.0hz,2h),2.49(t,j=7.0hz,2h),2.07
–
1.93(m,2h);
13
c nmr(101mhz,chloroform-d)δ133.35,129.43,128.82,127.63,119.16,26.16,25.82,17.13.
[0119]
实施例19:3-苯基-4-(苯基硒基)丁腈的制备
[0120]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入3-苯基环丁烷-1-酮o-全氟苯甲酰肟(71.0mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到3-苯基-4-(苯基硒基)丁腈(45.8mg)产率76%。
[0121][0122]
3-苯基-4-(苯基硒基)丁腈
[0123]1h nmr(400mhz,chloroform-d)δ7.51
–
7.42(m,2h),7.39
–
7.21(m,6h),7.18(d,j=7.9hz,2h),3.29(dd,j=12.3,6.2hz,1h),3.26
–
3.07(m,2h),2.86(dd,j=16.8,5.3hz,1h),2.75(dd,j=16.8,7.5hz,1h);
13
c nmr(101mhz,chloroform-d)δ140.70,133.23,129.45,129.11,129.09,128.04,127.64,127.15,118.21,42.27,32.71,24.16.
[0124]
实施例20:3-氰基-2-((苯基硒基)甲基)丙酸乙酯的制备
[0125]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入乙基-3-(((全氟苯甲酰)氧基)亚氨基)环丁烷-1-羧酸酯(70.2mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到3-氰基-2-((苯基硒基)甲基)丙酸乙酯(29.7mg)产率50%。
[0126][0127]
3-氰基-2-((苯基硒基)甲基)丙酸乙酯
[0128]1h nmr(600mhz,chloroform-d)δ7.57
–
7.51(m,2h),7.33
–
7.26(m,3h),4.11(ddq,j=41.3,10.7,7.1hz,2h),3.33(dd,j=13.1,5.6hz,1h),3.13(dd,j=13.2,7.4hz,1h),2.98
–
2.91(m,1h),2.80(dd,j=6.5,0.9hz,2h),1.24(t,j=7.1hz,3h);
13
c nmr(151mhz,chloroform-d)δ171.01,133.78,129.56,128.41,128.08,117.51,61.96,42.22,28.17,19.36,14.19.
[0129]
实施例21:4-(苯基硒基)戊腈的制备
[0130]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入2-甲基环丁烷-1-酮o-全氟苯甲酰肟(58.6mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到4-(苯基硒基)戊腈(35.4mg)产率74%。
[0131][0132]
4-(苯基硒基)戊腈
[0133]1h nmr(400mhz,chloroform-d)δ7.50
–
7.43(m,2h),7.21(p,j=7.6,7.2hz,3h),3.21(h,j=6.9hz,1h),2.45(td,j=7.3,5.1hz,2h),1.82(t,j=7.2hz,2h),1.36(d,j=6.9hz,3h);
13
c nmr(101mhz,chloroform-d)δ135.62,129.27,128.24,127.57,119.37,37.92,32.96,21.97,15.94;hrms(esi):m/z calcd for c
10h11
nse[m+h]
+
240.0291,found 240.0287.
[0134]
实施例22:2-((苯基硒基)甲氧基)乙腈的制备
[0135]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入3-氧杂环丁酮o-全氟苯甲酰肟(58.6mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),
三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-((苯基硒基)甲氧基)乙腈(35.4mg)产率78%。
[0136][0137]
2-((苯基硒基)甲氧基)乙腈
[0138]1hnmr(400mhz,chloroform-d)δ7.61
–
7.53(m,2h),7.36
–
7.27(m,3h),5.35(s,2h),4.45(s,2h);
13
c nmr(101mhz,chloroform-d)δ133.1,129.5,129.1,128.0,115.3,71.8,53.3.
[0139]
实施例23:2-(((苯基硒基)甲基)硫代)乙腈的制备
[0140]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入3-硫杂环丁酮o-全氟苯甲酰肟(59.4mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到2-(((苯基硒基)甲基)硫代)乙腈(30.1mg)产率62%。
[0141][0142]
2-(((苯基硒基)甲基)硫代)乙腈
[0143]1hnmr(400mhz,chloroform-d)δ7.62
–
7.55(m,2h),7.39
–
7.27(m,3h),4.13(s,2h),3.49(s,2h);
13
c nmr(101mhz,chloroform-d)δ134.1,129.5,128.5,128.4,116.7,29.9,17.7;hrms(esi):m/z calcd for c9h9nsse[m+h]
+
243.9699,found 243.9703.
[0144]
实施例24:5-(苯基硒基)己腈的制备
[0145]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入2-甲基环戊烷-1-酮o-全氟苯甲酰肟(61.4mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到5-(苯基硒基)己腈(38.5mg)产率79%。
[0146][0147]
5-(苯基硒基)己腈
[0148]1h nmr(400mhz,chloroform-d)δ7.59
–
7.52(m,2h),7.30(t,j=5.3hz,3h),3.25(h,j=6.7hz,1h),2.33(t,j=6.9hz,2h),1.83(p,j=6.5,6.0hz,2h),1.78
–
1.69(m,2h),1.43(d,j=6.9hz,3h);
13
c nmr(101mhz,chloroform-d)δ135.3,129.1,128.5,127.8,119.5,38.6,36.4,23.8,22.3,17.0;hrms(esi):m/z calcd for c
12h15
nsse[m+h]
+
254.0448,found 254.0446.
[0149]
实施例25:6-苯基-6-(苯基硒基)己腈的制备
[0150]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入2-苯基环己-1-酮o-全氟苯甲酰肟(76.6mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到6-苯基-6-(苯基硒基)己腈(50.7mg)产率77%。
[0151][0152]
6-苯基-6-(苯基硒基)己腈
[0153]1h nmr(400mhz,cdcl3)δ7.42
–
7.35(m,2h),7.27(d,j=3.2hz,1h),7.26
–
7.22(m,3h),7.20(dt,j=5.4,2.4hz,2h),7.16(dd,j=5.3,3.1hz,2h),4.23
–
4.17(m,1h),2.29
–
2.21(m,2h),2.14
–
1.97(m,2h),1.69
–
1.56(m,2h),1.53
–
1.36(m,2h);
13
c nmr(101mhz,cdcl3)δ141.8,135.5,129.3,128.8,128.4,127.9,127.6,127.1,119.4,47.9,35.2,27.5,25.0,17.0;hrms(esi):m/z calcd for c
18h19
nse[m+na]
+
352.0576,found 352.0587.
[0154]
实施例26:7-苯基-7-(苯基硒基)庚腈的制备
[0155]
在惰性气体保护下,称取双-(1,5-环辛二烯镍)(11.0mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入2-苯基环庚烷-1-酮o-全氟苯甲酰肟(79.4mg,0.2mmol),二苯基二硒醚(94.2mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应12h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到7-苯基-7-(苯基硒基)庚腈(53.2mg)产率78%。
[0156][0157]
7-苯基-7-(苯基硒基)庚腈
[0158]1h nmr(400mhz,chloroform-d)δ7.43
–
7.37(m,2h),7.30
–
7.16(m,8h),4.23(dd,j=9.0,6.4hz,1h),2.27(t,j=7.1hz,2h),2.13
–
1.99(m,2h),1.62
–
1.55(m,2h),1.43(dd,j=14.1,6.4hz,2h),1.37
–
1.27(m,2h);
13
c nmr(101mhz,chloroform-d)δ142.26,135.56,129.54,128.90,128.45,127.92,127.76,127.06,119.74,48.37,35.77,28.27,27.59,25.21,17.11;hrms(esi):m/z calcd for c
11h13
nse[m+na]
+
366.0736,found 366.0733.
[0159]
实施例27:4-(对甲苯基硒基)丁腈的制备
[0160]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入环丁酮o-全氟苯甲酰肟(55.8mg,0.2mmol),二(4-甲基苯基)二硒醚(102.6mg,1.5equiv),三
乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到4-(对甲苯基硒基)丁腈(40.2mg)产率84%。
[0161][0162]
4-(对甲苯基硒基)丁腈
[0163]1h nmr(600mhz,chloroform-d)δ7.41(d,j=8.0hz,2h),7.10(d,j=7.8hz,2h),2.94(t,j=7.0hz,2h),2.49(t,j=7.1hz,2h),2.33(s,3h),1.97(p,j=7.0hz,2h);
13
c nmr(151mhz,chloroform-d)δ137.9,133.9,130.3,124.9,119.2,26.5,25.8,21.3,17.1;hrms(esi):m/z calcd for c
11h13
nse[m+h]
+
240.0291,found 240.0292.
[0164]
实施例28:4-((4-氟苯基)硒基)丁腈的制备
[0165]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入环丁酮o-全氟苯甲酰肟(55.8mg,0.2mmol),二(4-氟苯基)二硒醚(105.0mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到4-((4-氟苯基)硒基)丁腈(26.0mg)产率54%。
[0166][0167]
4-((4-氟苯基)硒基)丁腈
[0168]1h nmr(600mhz,chloroform-d)δ7.56
–
7.46(m,2h),7.04
–
6.94(m,2h),2.94(t,j=7.0hz,2h),2.50(t,j=7.0hz,2h),1.97(p,j=7.0hz,2h);
13
c nmr(151mhz,chloroform-d)δ162.8(d,j=247.9hz),136.1(d,j=7.9hz),123.2(d,j=3.3hz),119.1,116.7(d,j=21.5hz),27.0,25.8,17.1;
19
f nmr(376mhz,chloroform-d)δ-113.70;hrms(esi):m/z calcd for c
10h10
fnse[m+h]
+
244.0040,found 244.0042.
[0169]
实施例29:4-(甲基硒基)丁腈的制备
[0170]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入环丁酮o-全氟苯甲酰肟(55.8mg,0.2mmol),二甲基二硒醚(57.0mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到4-(甲基硒基)丁腈(18.1mg)产率56%。
[0171][0172]
4-(甲基硒基)丁腈
[0173]1h nmr(600mhz,chloroform-d)δ2.66(t,j=7.0hz,2h),2.52(t,j=7.0hz,2h),2.07
–
1.96(m,5h);
13
c nmr(151mhz,chloroform-d)δ119.3,25.7,23.6,17.2,4.4.
[0174]
实施例30:4-(苄基硒基)丁腈的制备
[0175]
在惰性气体保护下,称取氯化亚铁(5.1mg,20mol%)、1,10-菲罗啉(7.2mg,20mol%)、1,4-二氧六环(6ml)加入史莱克管中,加热至80℃搅拌反应0.5h,冷却至室温后直接用于下一步。在装有催化剂-配体络合物的史莱克管中仍然在惰性气体保护下加入环丁酮o-全氟苯甲酰肟(55.8mg,0.2mmol),二苄基二硒醚(102.6mg,1.5equiv),三乙胺(202.4mg,10equiv)。室温搅拌反应24h。所得反应物用硅胶柱(石油醚/乙酸乙酯)纯化得到4-(苄基硒基)丁腈(30.4mg)产率64%。
[0176][0177]
4-(苄基硒基)丁腈
[0178]1h nmr(600mhz,chloroform-d)δ7.28(dt,j=10.6,7.2hz,4h),7.21(t,j=6.9hz,1h),3.77(s,2h),2.57(t,j=7.0hz,2h),2.39(d,j=14.1hz,2h),1.87(p,j=7.1hz,2h);
13
c nmr(151mhz,chloroform-d)δ138.9,128.9,128.8,127.1,119.2,27.4,25.9,22.1,17.2.
[0179]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 一种乙酰化改性高直链玉米淀粉...
- 一种桑蚕丝丝素重链蛋白多克隆...
- 一种金刚烷基微孔材料及其制备...
- 一种槐糖脂的用途及植物多糖的...
- 乙酰化高直链玉米淀粉与玉米醇...
- 包含硅橡胶和交联有机聚合物的...
- 检测脓毒症病原体的引物组合物...
- 一种促进人脐带间充质干细胞神...
- 一种用于抑制EGFR的2,4...
- 一种2,6-二取代嘌呤类化合...
- 还没有人留言评论。精彩留言会获得点赞!