CHO细胞的瞬时转染方法及重组CHO细胞与流程
本发明涉及生物工程领域,特别是涉及一种cho细胞的瞬时转染方法及重组cho细胞。
背景技术:
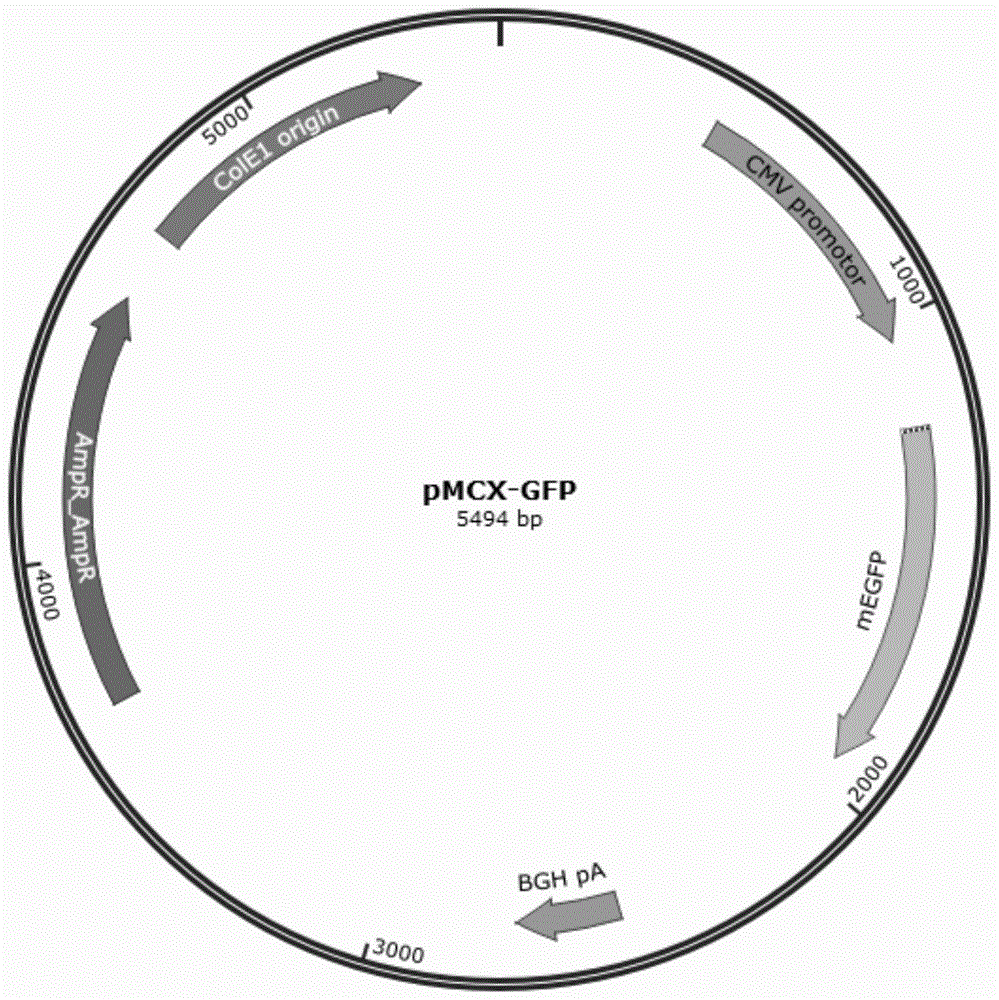
:真核细胞的转染分为瞬时转染和稳定转染。瞬时转染质粒dna进入细胞后不整合到染色体中,以游离状态表达外源基因。瞬时转染的周期短,能够快速获得目的蛋白,能够应用于研发起始阶段的摸索和大规模高通量筛选蛋白。cho细胞(chinesehamsterovarycell,中国仓鼠卵巢细胞)作为哺乳动物蛋白表达系统,被广泛地用来表达重组dna的蛋白。例如应用于抗体、基因重组蛋白质药物、病毒疫苗等生物技术产品的研究开发和工业化生产。然而,常用的cho细胞的瞬时转染方法的转染效率较低,且转染后细胞中目的基因的表达产量较低,不能满足实际需求。技术实现要素:基于此,有必要提供一种兼具较高转染效率和较高目的基因表达量的cho细胞的瞬时转染方法。此外,还有必要提供一种重组cho细胞。一种cho细胞的瞬时转染方法,包括如下步骤:以cho细胞悬液的细胞密度、转染试剂的添加量、含目的基因的质粒的添加量为因素,以所述目的基因的表达量和转染效率为响应变量,进行三因子九水平的均匀设计,根据所述均匀设计向所述cho细胞悬液中加入所述转染试剂和所述质粒进行瞬时转染,分析结果,获得瞬时转染工艺参数;根据所述瞬时转染工艺参数,以所述质粒的添加量和所述转染试剂的添加量为因素,以所述目的基因的表达量和所述转染效率为响应变量,进行二因子的正交设计,根据所述正交设计向所述cho细胞悬液中加入所述转染试剂和所述质粒进行瞬时转染,分析结果,获得包含所述cho细胞悬液的细胞密度、所述转染试剂的添加量以及所述质粒的添加量的瞬时转染条件;及根据所述瞬时转染条件,向所述cho细胞悬液中加入所述转染试剂和所述质粒进行瞬时转染,培养,得到重组cho细胞。上述cho细胞的瞬时转染方法中,通过向cho细胞悬液中加入转染试剂和含目的基因的质粒进行瞬时转染和培养,通过均匀设计和正交设计,获得瞬时转染条件,有利于提高转染效率,增加目的基因的表达量。经试验验证,采用上述cho细胞的瞬时转染方法将绿色荧光蛋白基因转入cho细胞中,转染效率为60.73%~62.95%,得到的重组细胞的相对荧光强度为6.71e+05~9.65e+05,绿色荧光蛋白的表达量较高。在其中一个实施例中,所述瞬时转染条件包括1.7×106个细胞/ml~2×106个细胞/ml的所述cho细胞悬液的细胞密度,2.4μg/ml~3μg/ml的所述转染试剂的添加量,7μg/ml~9μg/ml的所述质粒的添加量,且所述转染试剂为聚醚酰亚胺。在其中一个实施例中,所述以cho细胞悬液的细胞密度、转染试剂的添加量、含目的基因的质粒的添加量为因素,以所述目的基因的表达量和转染效率为响应变量,进行三因子九水平的均匀设计的步骤中,所述cho细胞悬液的细胞密度为1.75×106个细胞/ml~3.75×106个细胞/ml,所述转染试剂的添加量为5μg/ml~17μg/ml,所述质粒的添加量为1μg/ml~3μg/ml。在其中一个实施例中,所述根据所述均匀设计向所述cho细胞悬液中加入所述转染试剂和所述质粒进行瞬时转染,分析结果,获得瞬时转染工艺参数的步骤包括:根据所述均匀设计向所述cho细胞悬液中加入所述转染试剂和所述质粒进行瞬时转染,得到所述均匀设计对应的所述目的基因的表达量和所述转染效率;对所述cho细胞悬液的细胞密度、所述转染试剂的添加量、所述质粒的添加量和所述均匀设计得到的所述转染效率进行回归分析,获得第一回归模型;对所述cho细胞悬液的细胞密度、所述转染试剂的添加量、所述质粒的添加量和所述均匀设计得到的所述目的基因的表达量进行回归分析,获得第二回归模型;及分析所述第一回归模型和所述第二回归模型,获得所述瞬时转染工艺参数。在其中一个实施例中,所述根据所述正交设计向所述cho细胞悬液中加入所述转染试剂和所述质粒进行瞬时转染,分析结果,获得包含所述cho细胞悬液的细胞密度、所述转染试剂的添加量以及所述质粒的添加量的瞬时转染条件的步骤包括:根据所述正交设计向所述cho细胞悬液中加入所述转染试剂和所述质粒进行瞬时转染,得到所述正交设计对应的所述目的基因的表达量和所述转染效率;对所述转染试剂的添加量、所述质粒的添加量和所述正交设计得到的所述转染效率进行回归分析,获得第三回归模型;对所述转染试剂的添加量、所述质粒的添加量和所述正交设计得到的所述目的基因的表达量进行回归分析,获得第四回归模型;及分析所述第三回归模型和所述第四回归模型,获得所述瞬时转染条件。在其中一个实施例中,所述根据所述均匀设计向所述cho细胞悬液中加入所述转染试剂和所述质粒进行瞬时转染,分析结果,获得包含所述cho细胞悬液的细胞密度、所述转染试剂的添加量以及所述质粒的添加量的瞬时转染工艺参数的步骤之前,还包括制备所述cho细胞悬液的步骤:对cho细胞进行悬浮驯化培养,得到所述cho细胞悬液。在其中一个实施例中,所述cho细胞悬液还包括无血清培养基,所述无血清培养基包括4mmol/l~8mmol/l的谷氨酰胺、10mg/l~30mg/l的甘氨酸、10mg/l~50mg/l的蛋氨酸、0.5g/l~1g/l的嵌段式聚醚f-68及10μg/l~20μg/l的胰岛素类似物。在其中一个实施例中,所述cho细胞悬液中,所述cho细胞为cho-dg44细胞。在其中一个实施例中,所述转染试剂为分子量为20kd~50kd的聚醚酰亚胺。一种重组cho细胞,由上述cho细胞的瞬时转染方法制备得到。附图说明图1为pmcx-gfp质粒的结构示意图;图2为实施例2中转染效率与cho细胞悬液的细胞密度、质粒的添加量、转染试剂的添加量的关系图;图3为实施例2中相对荧光强度与cho细胞悬液的细胞密度、质粒的添加量、转染试剂的添加量的关系图;图4为实施例3中转染效率与cho细胞悬液的细胞密度、质粒的添加量、转染试剂的添加量的关系图;图5为实施例3中相对荧光强度与cho细胞悬液的细胞密度、质粒的添加量、转染试剂的添加量的关系图。具体实施方式为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。一实施方式的cho细胞的瞬时转染方法,包括如下步骤s110~s130:s110、以cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量为因素,以目的基因的表达量和转染效率为响应变量,进行三因子九水平的均匀设计,根据均匀设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,分析结果,获得瞬时转染工艺参数。均匀设计是我国数学家王元和方开泰发明,非常适用于实验水平多的实验,通过每个因素多个水平的设置,可一次实验就快速接近最优区域。均匀实验的多水平保证了实验是在较大范围内寻找最佳实验组合,通过均匀设计能够较好的预测最优的实验集合。在其中一个实施例中,以cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量为因素的步骤中,cho细胞悬液的细胞密度为1.75×106个/ml~3.75×106个/ml,转染试剂的添加量为5μg/ml~17μg/ml,质粒的添加量为1μg/ml~3μg/ml。在其中一个实施例中,cho细胞悬液中,cho细胞为cho-dg44细胞。需要说明的是,cho细胞不限于上述指出的cho细胞,也可以为其他cho细胞,例如可以为chok1细胞。在其中一个实施例中,cho悬浮细胞中,还包括无血清培养基。进一步地,无血清培养基包括4mmol/l~8mmol/l的谷氨酰胺、10mg/l~30mg/l的甘氨酸、10mg/l~50mg/l的蛋氨酸、0.5g/l~1g/l的嵌段式聚醚f-68及10μg/l~20μg/l的胰岛素类似物。谷氨酰胺是细胞生长的必须氨基酸,为培养的细胞提供重要的能量来源。在其中一个实施例中,无血清培养基包括5mmol/l~7mmol/l的谷氨酰胺。进一步地,无血清培养基包括6mmol/l的谷氨酰胺。在其中一些实施例中,无血清培养基包括4mmol/l、5mmol/l、6mmol/l、7mmol/l或者8mmol/l的谷氨酰胺。甘氨酸提供细胞生长所需营养。在其中一个实施例中,无血清培养基包括15mg/l~25mg/l的甘氨酸。进一步地,无血清培养基包括18mg/l~22mg/l的甘氨酸。在其中一些实施例中,无血清培养基包括10mg/l、12mg/l、15mg/l、18mg/l、20mg/l、22mg/l、25mg/l、28mg/l或者30mmol/l的甘氨酸。蛋氨酸提供细胞生长所需营养。在其中一个实施例中,无血清培养基包括20mg/l~40mg/l的蛋氨酸。进一步地,无血清培养基包括25mg/l~35mg/l的蛋氨酸。在其中一些实施例中,无血清培养基包括10mg/l、15mg/l、20mg/l、25mg/l、30mg/l、35mg/l、40mg/l、45mg/l或者50mmol/l的蛋氨酸。f68,即嵌段式聚醚f-68,是一种非离子表面活性剂,是聚氧乙烯、聚氧丙烯嵌段聚合物,分子量大约8400da。f68能够保护细胞,以避免细胞因转移和搅拌而受到损害,并且能够防止空气粘附于细胞,提高细胞的抵抗力,还能够增强细胞之间的交互作用。在其中一个实施例中,无血清培养基包括0.6g/l~0.9g/l的f68。进一步地,无血清培养基包括0.75g/l的f68。在其中一些实施例中,无血清培养基包括0.5g/l、0.55g/l、0.6g/l、0.65g/l、0.7g/l、0.75g/l、0.8g/l、0.85g/l、0.9g/l、0.95g/l或者1g/l的f68。胰岛素类似物能够增加细胞活性,促进细胞增殖。在其中一个实施例中,胰岛素类似物为人胰岛素类似物。进一步地,胰岛素类似物为人重组胰岛素(即重组人胰岛素)。需要说明的是,胰岛素类似物不限于为人重组胰岛素,也可以为其他胰岛素类似物,例如可以为重组猪胰岛素。在其中一个实施例中,无血清培养基包括13μg/l~17μg/l的胰岛素类似物。进一步地,无血清培养基包括15μg/l的胰岛素类似物。在其中一些实施例中,无血清培养基包括10μg/l、11μg/l、12μg/l、13μg/l、14μg/l、15μg/l、16μg/l、17μg/l、18μg/l、19μg/l或者20μg/l的胰岛素类似物。需要说明的是,无血清培养基不限于上述指出的培养基,还可以为其他无血清培养基,例如可以为procho5培养基。在其中一个实施例中,质粒中目的基因为荧光蛋白基因。进一步地,质粒中目的基因为绿色荧光蛋白基因。具体地,绿色荧光蛋白基因的序列如seqidno.1所示。具体地,如seqidno.1所示的序列为:5’-atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggacggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctacggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccaccctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaagcagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttcttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctggtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcacaagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaacggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgccgaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccactacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtcctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaagtaa-3’。需要说明的是,质粒中的目的基因不限于为绿色荧光蛋白基因,也可以为其他颜色的荧光蛋白基因。需要说明的是,质粒中的目的基因不限于为荧光蛋白基因,也可以为其他目的基因。在一个具体示例中,质粒为pmcx-gfp质粒。其结构示意图如图1所示。图1中,“bghpa”表示bghpa终止子;“cmvpromotor”表示cmv启动子;“megfp”表示绿色荧光蛋白基因。在其中一个实施例中,转染试剂为分子量为20kd~50kd的聚醚酰亚胺。此种设置有利于提高转染效率。在其中一个实施例中,根据均匀设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染的步骤中,向cho细胞悬液中加入转染试剂和质粒在34℃~37℃、5%~8%的co2、150rpm~200rpm下进行瞬时转染。在其中一个实施例中,根据均匀设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,分析结果,获得瞬时转染工艺参数的步骤包括s111~s114:s111、根据均匀设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,得到均匀设计对应的目的基因的表达量和转染效率。s112、对cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量和均匀设计得到的转染效率进行回归分析,获得第一回归模型。在其中一个实施例中,对cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量和均匀设计得到的转染效率进行回归分析的步骤中,对cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量和均匀设计得到的转染效率进行二次多项式逐步回归分析。在其中一个实施例中,第一回归模型的方程为y1=-c1+c2x2+c3x3+c4x1*x1-c5x2*x2-c6x3*x3-c7x1*x2,其中,y1为转染效率,x1为cho细胞悬液的细胞密度,x2为质粒的添加量,x3为转染试剂的添加量。进一步地,第一回归模型的方程为y1=-104.41+76.59x2+11.49x3+1.13x1*x1-12.40x2*x2-0.51x3*x3-6.32x1*x2,其中,y1为转染效率,x1为cho细胞悬液的细胞密度,x2为质粒的添加量,x3为转染试剂的添加量。s113、对cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量和均匀设计得到的目的基因的表达量进行回归分析,获得第二回归模型。在其中一个实施例中,对cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量和均匀设计得到的目的基因的表达量进行回归分析的步骤中,对cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量和均匀设计得到的目的基因的表达量进行二次多项式逐步回归分析。在其中一个实施例中,第二回归模型的方程为y2=d1-d2x1+d3x2-d4x3+d5x3*x3+d6x1*x3,其中,y2为目的基因的表达量,x1为cho细胞悬液的细胞密度,x2为质粒的添加量,x3为转染试剂的添加量。进一步地,第二回归模型的方程为y2=881290.97-60575.49x1+36361.70x2-80778.94x3+1639.96x3*x3+5816.12x1*x3,其中,y2为目的基因的表达量,x1为cho细胞悬液的细胞密度,x2为质粒的添加量,x3为转染试剂的添加量。s114、分析第一回归模型和第二回归模型,获得瞬时转染工艺参数。在其中一个实施例中,瞬时转染工艺参数包括:1.75×106个/ml的cho细胞悬液的细胞密度、2.64μg/ml~3μg/ml的转染试剂的添加量、5μg/ml~11.19μg/ml的质粒的添加量。在其中一个实施例中,根据均匀设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,分析结果,获得包含cho细胞悬液的细胞密度、转染试剂的添加量以及质粒的添加量的瞬时转染工艺参数的步骤之前,还包括驯化cho的步骤:对cho细胞进行悬浮驯化培养。cho细胞通常为有血清贴壁生长。通过将贴壁cho细胞置于无血清培养基中进行悬浮驯化培养,能够提高cho细胞的细胞生长密度和蛋白产量。进一步地,对贴壁cho细胞进行悬浮驯化培养的步骤包括:将贴壁cho细胞置于含血清的培养基中培养,在培养过程中通过替换培养基以使培养基中的血清含量逐渐降低直至cho细胞适应无血清培养,当细胞生长速率和活率均稳定后,视为驯化完成。其中,含血清的培养基包括血清及无血清培养基。进一步地,无血清培养基包括procho5培养基。需要说明的是,无血清培养基不限于上述指出的培养基,还可以为其他无血清培养基,例如可以为其他市售的无血清培养基。具体地,将贴壁cho细胞置于含血清的培养基中培养,在培养过程中通过替换培养基以使培养基中的血清含量逐渐降低直至cho细胞适应无血清培养的步骤包括:将贴壁cho细胞置于含质量百分含量为5%的血清的培养基中,37℃、5%co2、180rpm培养48h~72h后,每隔48h~72h,通过稀释传代替换培养基,接种密度0.5×106个/ml~1.0×106个/ml,并使培养基中的血清的质量百分含量降低1.25%~2.5%继续培养,直至使cho细胞适应无血清培养。固液分离的条件为800rpm~1500rpm,5min~10min。s120、根据瞬时转染工艺参数,以质粒的添加量和转染试剂的添加量为因素,以目的基因的表达量和转染效率为响应变量,进行二因子的正交设计,根据正交设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,分析结果,获得包含cho细胞悬液的细胞密度、转染试剂的添加量以及质粒的添加量的瞬时转染条件。根据实验集合进行正交实验,能够找出最优的瞬时转染条件,且能够对均匀设计实验的实验集合进行验证。在其中一个实施例中,根据正交设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染的步骤中,向cho细胞悬液中加入转染试剂和质粒在34℃~37℃、5%~8%的co2、150rpm~200rpm下进行瞬时转染。在其中一个实施例中,根据正交设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,分析结果,获得包含cho细胞悬液的细胞密度、转染试剂的添加量以及质粒的添加量的瞬时转染条件的步骤包括s121~s124:s121、根据正交设计向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,得到正交设计对应的目的基因的表达量和转染效率。s122、对转染试剂的添加量、质粒的添加量和正交设计得到的转染效率进行回归分析,获得第三回归模型。在其中一个实施例中,第三回归模型的方程为y3=e1+e2a2。其中,y3为转染效率,a为质粒的添加量。进一步地,第三回归模型的方程为y3=47.87+1.48a2。其中,y3为转染效率,a为质粒的添加量。s123、对转染试剂的添加量、质粒的添加量和正交设计得到的目的基因的表达量进行回归分析,获得第四回归模型。在其中一个实施例中,第四回归模型的方程为y4=f1-f2b。其中,y4为目的基因的表达量,b为转染试剂的添加量。进一步地,第四回归模型的方程为y4=1782678.40-107457.41b。其中,y4为目的基因的表达量,b为转染试剂的添加量。s124、分析第三回归模型和所述第四回归模型,获得瞬时转染条件。在其中一个实施例中,瞬时转染条件包括1.7×106个细胞/ml~2×106个细胞/ml的cho细胞悬液的细胞密度,2.4μg/ml~3μg/ml的转染试剂的添加量,7μg/ml~9μg/ml的质粒的添加量,且转染试剂为聚醚酰亚胺。s130、根据瞬时转染条件,向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,培养,得到重组cho细胞。在其中一个实施例中,向cho细胞悬液中加入转染试剂和质粒进行瞬时转染,培养,得到重组细胞的步骤包括:向cho细胞悬液中加入转染试剂和基因的质粒在34℃~37℃、5%~8%的co2、150rpm~200rpm下进行瞬时转染,转染后置于34℃~37℃、5%~8%的co2、150rpm~200rpm下培养24h~48h,得到重组细胞。上述cho细胞的瞬时转染方法中,通过向cho细胞悬液中加入转染试剂和含目的基因的质粒进行瞬时转染和培养,通过均匀设计和正交设计,获得瞬时转染条件,有利于提高转染效率,增加目的基因的表达量。经试验验证,采用上述cho细胞的瞬时转染方法将绿色荧光蛋白基因转入cho细胞中,转染效率为60.73%~62.95%,得到的重组细胞的相对荧光强度为6.71e+05~9.65e+05,绿色荧光蛋白的表达量较高。上述cho细胞的瞬时转染方法中,通过向cho细胞悬液中加入转染试剂和含目的基因的质粒进行瞬时转染和培养,控制cho细胞悬液中cho细胞的浓度为1.7×106个/ml~2×106个/ml,以聚醚酰亚胺为转染试剂,将转染试剂的添加量控制为2.4μg/ml~3μg/ml,将质粒的添加量控制为7μg/ml~9μg/ml,有利于提高转染效率,增加目的基因的表达量。瞬时转染的效率受多种因素影响,如转染时细胞密度、质粒的添加量、转染试剂的添加量等。而目前优化瞬时转染的方法大多采用单因子法(固定所有其他因子不变,每次只变动一个因子进行实验),且主要考虑转染效率的优化,但其缺点是:不能发现最佳因子的组合,实验非常没有效率。另外,单因子法还与开始条件有关,开始设置不同,结果也有可能不同,导致转染效率不能得到快速有效的优化。同时,单纯考虑转染效率而忽视蛋白表达水平也不能使最终的蛋白表达的总产量得到有效提升。当因素的个数不多的时候(因素的个数≤3),一般实验设计的策略是先用二水平正交实验研究因子的主效应和交互效应,再通过最速下降法到达最优区域,最后在最优区域内再进行响应面分析确定最优点,但这样做实验次数较多,周期较长。上述cho细胞的瞬时转染方法,通过实验设计,以转染效率和目的基因表达量作为优化指标,以cho细胞悬液的细胞密度、质粒的添加量和转染试剂的添加量作为因子,首先通过均匀设计拟合模型预测优选的实验集合,再通过正交实验确定是转染效率和目的基因表达量,通过两次实验设计即可达到最优的瞬时转染条件,简单易行。以下为具体实施例部分:实施例中采用试剂和仪器如非特别说明,均为本领域常规选择。实施例中未注明具体条件的实验方法,通常按照常规条件,例如文献、书本中所述的条件或者试剂盒生产厂家推荐的方法实现。实施例中所使用的试剂均为市售。如未特别说明,以下实施例中,chodg44细胞为市售的chodg44细胞,且批号为20180325。pmcx-gfp质粒即含有绿色荧光蛋白基因的质粒,绿色荧光蛋白基因如seqidno.1所示,购于excellgene公司。人重组胰岛素购于赛默飞世尔公司。实施例1cho细胞的驯化:(1)将chodg44细胞按照0.5×106个细胞/ml接种于含有质量百分含量为5%的血清的procho5培养基中,37℃、5%co2下贴壁培养72h,得到贴壁cho细胞。(2)将贴壁cho细胞置于含质量百分含量为5%的血清的培养基中,37℃、5%co2、180rpm培养,含质量百分含量为5%的血清的培养基包括无血清培养基和质量百分含量为5%的血清。培养72h后,每隔60h替换培养基并使培养基中的血清的质量百分含量降低2.5%继续培养,直至使cho细胞在无血清培养基培养72h,得到驯化后的cho细胞。培养结束后,1000rpm离心5min,弃去上清,得到驯化后的细胞。无血清培养基为procho5培养基(批号为20180112)。实施例2均匀设计的实验过程:以cho细胞悬液的细胞密度、转染试剂的添加量、质粒的添加量为因素,以目的基因的表达量和转染效率为响应变量,进行三因子九水平的均匀设计,获得瞬时转染工艺参数。具体操作过程如下:(1)按照实施例1的操作制备驯化后的细胞,向驯化后的细胞中加入无血清培养基,混匀,得到cho细胞悬液。其中,无血清培养基包括6mmol/l的谷氨酰胺、20mg/l的甘氨酸、30mg/l的蛋氨酸、7.5g/l的f68及15μg/l的胰岛素类似物。胰岛素类似物为人重组胰岛素。(2)以cho细胞悬液的细胞密度(1.75×106个/ml~3.75×106个/ml)、转染试剂的添加量(5μg/ml~17μg/ml)、质粒的添加量(1μg/ml~3μg/ml)为因素,以目的基因的表达量和转染效率为响应变量,进行三因子九水平的均匀设计,得到均匀设计表u9(93),详见表1。表1对应9组实验,分别为实验1~9。根据表1的参数,并按照如下操作进行9组实验:向cho细胞悬液中加入转染试剂和pmcx-gfp质粒于37℃、5%co2、180rpm进行瞬时转染;转染后,继续培养48h,得到重组cho细胞。转染试剂为分子量为25kd的聚醚酰亚胺。采用流式细胞技术测定各组实验的转染效率,采用流式细胞技术测定重组cho细胞的相对荧光强度,测定结果详见表1。表1中y1为转染效率,y2为相对荧光强度(即目的基因的表达量),x1为cho细胞悬液的细胞密度,x2为质粒的添加量,x3为转染试剂的添加量。表1均匀设计表u9(93)(3)用dps数据处理系统对表1中的数据进行二次多项式逐步回归分析,分别以转染效率(y1)和相对荧光强度(y2)作为响应变量,获得对应的回归模型和趋势图。其中,转染效率的回归模型方程为y1=-104.41+76.59x2+11.49x3+1.13x1*x1-12.40x2*x2-0.51x3*x3-6.32x1*x2。转染效率的回归模型方程对应的趋势图详见图2。图2中,箭头(2-1)所指的曲线表示的是y1随x1变化的曲线;箭头(2-2)所指的曲线表示的是y1随x2变化的曲线;箭头(2-3)所指的曲线表示的是y1随x3变化的曲线。相对荧光强度的回归模型方程为y2=881290.97-60575.49x1+36361.70x2-80778.94x3+1639.96x3*x3+5816.12x1*x3。相对荧光强度的回归模型方程对应的趋势图详见图3。图3中,箭头(3-1)所指的曲线表示的是y2随x1变化的曲线;箭头(3-2)所指的曲线表示的是y2随x2变化的曲线;箭头(3-3)所指的曲线表示的是y2随x3变化的曲线。从图2可以看出,转染效率随着细胞密度的增加而降低,随着质粒的添加量的增加先升高后降低,随着转染试剂的添加量的增加先升高后降低。根据转染效率的回归模型获得在转染效率最高时,细胞密度为1.75×106/ml,质粒的添加量为2.64μg/ml,转染试剂的添加量为11.19μg/ml。从图3可以看出,相对荧光强度随着细胞密度的增加而降低,随着质粒的添加量的增加而升高,随着转染试剂的添加量的增加而降低。根据相对荧光强度的回归模型获得在相对荧光强度最高时,细胞密度为1.75×106/ml,质粒的添加量为3μg/ml,转染试剂的添加量为5μg/ml。综上所述,通过均匀设计,得到的瞬时转染工艺参数包括:1.75×106个/ml的cho细胞悬液的细胞密度、2.64μg/ml~3μg/ml的转染试剂的添加量、5μg/ml~11.19μg/ml的质粒的添加量。实施例3正交设计的实验过程:为了使蛋白表达量达到最高,要兼顾转染效率和相对荧光强度,而细胞密度虽然降低会一定程度上提高转染效率,但结合实际情况不能选择过低的细胞密度,因此后续实验选择将cho细胞悬液的细胞密度固定于1.75×106个/ml,而质粒的添加量和转染试剂的添加量通过二因子正交设计继续进行优化。即根据实施例2的瞬时转染工艺参数,以质粒的添加量和转染试剂的添加量为因素,以目的基因的表达量和转染效率为响应变量,进行二因子的正交设计,获得瞬时转染条件。具体实验过程如下:(1)按照实施例2中步骤(2)的操作制备cho细胞悬液。(2)以转染试剂的添加量(8μg/ml~12μg/ml)、质粒的添加量(0μg/ml~3μg/ml)为因素,以目的基因的表达量和转染效率为响应变量,进行二因子的正交设计,得到正交设计表,详见表2。表2对应7组实验,分别为实验1~7。根据表2的参数,并按照如下操作进行7组实验:向cho细胞悬液中加入转染试剂和pmcx-gfp质粒于37℃、5%co2、180rpm进行瞬时转染;转染后,继续培养48h,得到重组cho细胞。转染试剂为分子量为25kd的聚醚酰亚胺(批号为20170523)。cho细胞悬液的细胞密度为1.75×106个/ml。采用流式细胞技术测定各组实验的转染效率,采用流式细胞技术测定重组cho细胞的相对荧光强度,测定结果详见表2。表2中,y3为转染效率,y4为相对荧光强度(即目的基因的表达量),a为质粒的添加量,b为转染试剂的添加量。表2正交设计表中心点a(μg/ml)b(μg/ml)y3(%)y4(×105)实验102.51062.726.41实验212854.768.81实验313860.739.65实验4121252.855.09实验502.51062.956.71实验6131261.714.78实验702.51061.966.23(3)用dps数据处理系统对表2中的数据进行二次多项式逐步回归分析,分别以转染效率(y3)和相对荧光强度(y4)作为响应变量,获得对应的回归模型和趋势图。其中,转染效率的回归模型方程为y3=47.87+1.48a2。转染效率的回归模型方程对应的趋势图详见图4。图4中,箭头(4-1)所指的曲线表示的是y3随a变化的曲线;箭头(4-2)所指的曲线表示的是y3随b变化的曲线。相对荧光强度的回归模型方程为y4=1782678.40-107457.41b。相对荧光强度的回归模型方程对应的趋势图详见图5。图5中,箭头(5-1)所指的曲线表示的是y4随a变化的曲线;箭头(5-2)所指的曲线表示的是y4随b变化的曲线。从图4可以看出,转染效率随着质粒的添加量的增加而增加,并且在本实施例的范围内,转染试剂的添加量已对转染效率没有明显影响。根据回归模型获得转染效率最高时,质粒的添加量为3μg/ml,转染试剂的添加量为10.4μg/ml,但由于转染试剂的添加量在8μg/ml~12μg/ml的范围内对转染效率无影响,因此主要考虑质粒的添加量即可。从图5可以看出,在本实施例的范围内,质粒的添加量对相对荧光强度没有明显影响;相对荧光强度随着转染试剂的添加量的增加而降低。根据回归模型获得相对荧光强度最高时,质粒的添加量为2.45μg/ml,转染试剂的添加量为8μg/ml。但由于质粒的添加量在2μg/ml~3μg/ml的范围内对相对荧光强度无影响,因此,主要考虑转染试剂的添加量即可。综上所述,综合考虑对cho细胞进行瞬时转染的转染效率和目的基因的表达量,得到对cho细胞进行瞬时转染的条件为:1.7×106个/ml~2×106个/ml的cho细胞悬液的细胞密度、2.4μg/ml~3μg/ml的转染试剂的添加量、7μg/ml~9μg/ml的质粒的添加量。在此条件下,转染效率较高,且目的蛋白表达量较高。实施例4本实施例的cho细胞瞬时转染得到重组cho细胞的过程如下:(1)按照实施例1的制备过程得到驯化后的cho细胞。将驯化后的cho细胞在1,000rpm离心5min,弃去上清,加入无血清培养基,调整cho细胞的密度,得到cho细胞悬液,cho细胞悬液的细胞密度为1.7×106个/ml。无血清培养基包括4mmol/l的谷氨酰胺、10mg/l的甘氨酸、10mg/l的蛋氨酸、0.5g/l的f68及10μg/l的胰岛素类似物。胰岛素类似物为人重组胰岛素。(2)向cho细胞悬液中加入转染试剂和pmcx-gfp质粒于37℃、5%co2、180rpm进行瞬时转染;转染后,继续培养48h,得到重组cho细胞。转染试剂为分子量为20kd的聚醚酰亚胺(批号为20170523)。转染试剂的添加量为2.4μg/ml。质粒的添加量为7μg/ml。实施例5本实施例的cho细胞瞬时转染得到重组cho细胞的过程如下:(1)按照实施例1的制备过程得到驯化后的cho细胞。将驯化后的cho细胞在500rpm离心15min,弃去上清,加入无血清培养基,调整cho细胞的密度,得到cho细胞悬液,cho细胞悬液的细胞密度为2×106个/ml。无血清培养基包括8mmol/l的谷氨酰胺、30mg/l的甘氨酸、50mg/l的蛋氨酸、1g/l的f68及20μg/l的胰岛素类似物。胰岛素类似物为人重组胰岛素。(2)向cho细胞悬液中加入转染试剂和pmcx-gfp质粒于37℃、5%co2、180rpm进行瞬时转染;转染后,继续培养24h,得到重组cho细胞。转染试剂为分子量为50kd的聚醚酰亚胺。转染试剂的添加量为3μg/ml。质粒的添加量为9μg/ml。实施例6本实施例的cho细胞瞬时转染得到重组cho细胞的过程如下:(1)按照实施例1的制备过程得到驯化后的cho细胞。将驯化后的cho细胞在1,000rpm离心5min,弃去上清,加入无血清培养基,调整cho细胞的密度,得到cho细胞悬液,cho细胞悬液的细胞密度为1.85×106个/ml。无血清培养基包括6mmol/l的谷氨酰胺、20mg/l的甘氨酸、30mg/l的蛋氨酸、7.5g/l的f68及15μg/l的胰岛素类似物。胰岛素类似物为人重组胰岛素。(2)向cho细胞悬液中加入转染试剂和pmcx-gfp质粒于37℃、5%co2、180rpm进行瞬时转染;转染后,继续培养36h,得到重组cho细胞。转染试剂为分子量为25kd的聚醚酰亚胺。转染试剂的添加量为2.7μg/ml。质粒的添加量为8μg/ml。实施例7本实施例的cho细胞瞬时转染得到重组cho细胞的过程如下:(1)按照实施例1的制备过程得到驯化后的cho细胞。将驯化后的cho细胞在1,000rpm离心5min,弃去上清,加入无血清培养基,调整cho细胞的密度,得到cho细胞悬液,cho细胞悬液的细胞密度为1.85×106个/ml。无血清培养基为procho5培养基。(2)向cho细胞悬液中加入转染试剂和pmcx-gfp质粒于37℃、5%co2、180rpm进行瞬时转染;转染后,继续培养36h,得到重组cho细胞。转染试剂为分子量为25kd的聚醚酰亚胺。转染试剂的添加量为2.7μg/ml。质粒的添加量为8μg/ml。实施例8本实施例的cho细胞瞬时转染得到重组cho细胞的过程与实施例6大致相同,不同之处在于,转染试剂为分子量为60kd的聚醚酰亚胺。实施例9本实施例的cho细胞瞬时转染得到重组cho细胞的过程与实施例6大致相同,不同之处在于,转染试剂为分子量为10kd的聚醚酰亚胺。测试:测定实施例4~9中cho细胞瞬时转染的转染效率和重组cho细胞的相对荧光强度,测定结果详见表3。其中,采用流式细胞术测定转染效率,采用流式细胞术测定重组cho细胞的相对荧光强度。表3表示的是实施例4~9的cho细胞瞬时转染的转染效率和重组cho细胞的相对荧光强度。表3从表3可以看出,实施例4~9的cho细胞瞬时转染的转染效率为58.48%~60.73%,重组cho细胞的相对荧光强度8.52×105~9.65×105,说明在cho细胞悬液的细胞密度为1.7×106个/ml、质粒用量3μg/ml和转染试剂用量8μg/ml时,cho细胞瞬时转染的转染效率和相对荧光强度的都在较高水平。综上所述,上述cho细胞的瞬时转染方法兼具较高转染效率和较高目的基因表达量,能够用于cho细胞的瞬时转染以表达目的基因,并且为cho细胞的瞬时转染以表达各类目的基因的转染方法提供参考。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。序列表<110>佛山汉腾生物科技有限公司广州汉腾生物科技有限公司<120>cho细胞的瞬时转染方法及重组cho细胞<160>1<170>siposequencelisting1.0<210>1<211>720<212>dna<213>人工序列(artificialsequence)<400>1atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggac60ggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctac120ggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccacc180ctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaag240cagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttc300ttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctg360gtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcac420aagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaac480ggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgcc540gaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccac600tacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtc660ctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaagtaa720当前第1页12
- 构建强力霉素/米非司酮诱导过...
- xCas9n-epBE碱基编...
- 一种小麦株型调控基因及其应用...
- 一种提高酵母mRNA表达效率...
- 一种恶臭假单胞菌自杀载体的构...
- 一种产烟酸的超级重组耻垢分枝...
- 一种延缓皮肤衰老基因工程核酸...
- PGB蛋白在构建具有类伴侣样...
- 一种多重组氨酸序列标签及其在...
- 一种人抑制素A的核苷酸序列及...
- 还没有人留言评论。精彩留言会获得点赞!