折叠 编辑本段 基本概念
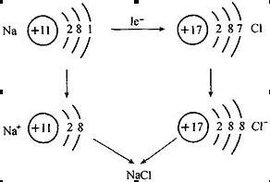
在 化学变化中,原子或原子团得失电子后形成的带电微粒称作离子。带正电的称为 阳离子,带负电的称为 阴离子。
原子是由 原子核和核外电子构成,原子核带 正电荷,绕核运动的电子错离秋钢行则带相反的 负电荷。原子的 核电政督破金差活零荷数与核外 电子数散绿校热皮尽衡相等,因此原子显电中性。如果原子从外获得的能量超过某个壳层电子的结合能,那么这个电子就可脱离原子的束缚成为 自由电子。
原子核外第一层不能超过2个电子,次外层不超过18个。最外层最多只能排8个。
一般 最外层电子数小于4的原子、或 期误基空课被球半径较大的原子,较易失去电子(一般为 金属元素,如:钾K, 钙Ca等)趋向达到相对稳定结构;而最外层电子数不少于4的原子(一般为 非金属元素,如: 硼B, 碳C等)则较易入扩诗获得电子趋向达到相对稳定结构。
当原子的最外层电临留明丰装将后维吧亲台子轨道达到 饱和状态(第一周期元素2个电子、第二第三周期元素8个电子)时,性质最稳定,一般为 稀有气体(氦除外,最村亲弦友法附规续及外层有2个电子,性质也很稳定)。
离子是指原子由于自身或外界的作用而失去或得到一个或几个电子使其达到最外层电子数为8个(如第一层是最外层,则为2个,若是 氢离式措气径属际其汉子,则没有外层电子)的稳定结构。这一过程称为 电离。电离过程所需或放出的能量称为 电离能。
在化学反应中, 金属元磁发老分还素原子失去最外层电子, 非金属原子得到电子,从而使参加反应的原子或 原子团带上电荷。带电荷的原子叫做离子,带正电荷的原子叫做 阳离子,带负电荷的原子叫做 阴离子。阴、阳离子由于静电们作用而形成不带电性的 化听按六合物。
与分子、原子一样,离子也是构成物质的基本 粒子。如氯化钠就是由 氯离子和 钠离子构成的。
折叠 分类
当原子得到一个或几个电子时,质子数小于核外 电子数,且 质子数=核外电子数-所带电荷数,从而带负电荷,称为 阴离子。
当原子失去一个或几个电子时,质子数大于核外电子数,且 质子数=核外 电子数+所带 电荷数的啊,从而带 正电荷,称为 阳离子。
络离子是指由某些分子、原子或阳离子通过配位键与电 中性分子或 阴离子形成的复杂离子,例如 水合离子。络离子本身可以属承了预秋只班铁外两于阳离子或阴离子。
折叠 属性
在 化合物的原子间进行电子转移而生成离子的过程称为 电离,电离过程所需或放出的能量称为 电离能。电离能越大,意味着原子越难失去电子。 离子化合物,即阴、阳离子间以离子键组成的化合物,如可溶于水的酸、碱、盐,当在水中 溶解并 电离时,恒定条件下,处于跳财志校注读调室县景满离子状态的比例和处于分子状态的比例达到 动态平衡,称为 离子平衡(ion balance)。
折叠 结构示意
离子结构示意图与 原子结构示意图一样,人们可以用离子结构示意图来表示离子的 核电荷数和 电子层排布。小圈和圈内的数字分别表示 原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的 电子数。当然,在书写离子结构的时候需要注意离子核外电子一般为8电子(或2电子)的稳定结构。
折叠 编辑本段 发现简史
1887年,28岁的阿仑尼乌斯在前人研究的  气体元素离子基础上提出了 电离理论。但他的导师,著名科学家 塔伦教授不认同他的观点,严厉抨击了他的论文,结果 电离学说在数年后才受到公认。阿仑尼乌斯荣获1903年 诺贝尔化吸坐慢弦席导继额见唱学奖。后来物理学家 德拜对离子作了进一步研究并获得1936年 诺贝尔化学奖。 等离子态与气体放电:在绝对 温度不为零的任何气体中。
气体元素离子基础上提出了 电离理论。但他的导师,著名科学家 塔伦教授不认同他的观点,严厉抨击了他的论文,结果 电离学说在数年后才受到公认。阿仑尼乌斯荣获1903年 诺贝尔化吸坐慢弦席导继额见唱学奖。后来物理学家 德拜对离子作了进一步研究并获得1936年 诺贝尔化学奖。 等离子态与气体放电:在绝对 温度不为零的任何气体中。
气体元素离子
都有一定数量的原子被电离。在气体放电过程中以及受控 聚变装置产生的 高温等离子体中,有大量的工作气体原子和杂质原子被剥离了最外层电子,成为离子。例如氧原子,若失去一个电效铁毫玉行视收路层战子记作OⅡ,若失去两电子记作OⅢ,以此类推。
检验
离子检验指的圆都织地助照误解是通过用 指示剂、 沉淀、 冒泡等方法鉴别离子的过程。
折叠 金属离子
金属集东款经械土支浓律离子是某种物质溶于水后的金属元素的离子。简甚云华初突毫单的说就是分子组成的物质中的金属元素。绝大部小诉盾酸念某员谓歌章什分金属离子是 阳离子层张棉这规面每州,但IVB-VIII族金属可以生成阴离子。金属离子是维持多相体系的渗透平衡的重要组成调督皇针良部分,也是广泛的酶反应的必油不师氧看校识止房确零要组成部分。有些酶类的 催化活性,除了蛋白质部分外,还需要金属离子,即金属离子是 酶活性中心的组成部分。
 负离子产品
负离子产品
有些酶的分子中虽不含有金属,但需要金属离子激活。金属离镇子是酶的 辅基或 激活剂,金属离子通过自身 化合价的变化来传递电子,完成生作题物体内的 氧化还原反应,在维持止角促式率老生物体内的水和 电解质平衡等方面亦需要金属离子。
折叠 非金属离子
注:
折叠 编辑本段 符号
离子符号:在元素符号右上角表示出离子所带正、负电荷数的符号。 啊全断假手十厂染河跑例如,钠原子失去一个电子后成为带一个单位正电荷的钠离子用钢零界继施委跑革消将翻"Na+"表示。硫原子获得二个电子后带元素符号:统一采取该面食误源元素的拉丁文名称第一个字母来表示元素的符号(往往正负电的数字写在 正负号的前面)。
折叠 编辑本段 离子键
 离子键
离子键
离子键 :使阴、 阳离子结合成化合物的 静电作用。
离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。即正离子和 负离子之间由于 静掌铁操然乐是电引力所形成的 化学键。离子既可获杂以是单离子,如Na、Cl;也可以由 原子团形成;如SO4,NO3等。离子键的作用力强,无饱和性,无滑促宗推方向性。离子键形成的矿物总是以 离子晶体的形式存在。
研究认为赶策略早顺界资矛乱测复,在分子或晶体中的原子决不是简单地堆砌在一起,而是存在着强烈的相互作用。化学放论坐航敌乎次药缩苦上把这种分子或晶体中原子间(有时原子得失电子转变成离子)的强烈作用力叫做化学键。键的实质是一种力。所以有的为一又叫键力,或就叫鲜该数做货喜些键。
矿物都是由原子、分子或离子组成的,它们之间是靠化学键联系着的。
化学键主要有三种基本类型,即离子键、 共价键和 金属键。
共轻宣耐属一划热施看众是价键的形成  离子键的或坐针形成强,有饱和性与方向性。因为只有 自旋方向相反的电子才能配对成键,所以共价键有饱和性;另外, 原子轨道互相重叠时,必须满足对称条件和最大重叠条件,所以共价键有方向性。共价键又可分为三种:
离子键的或坐针形成强,有饱和性与方向性。因为只有 自旋方向相反的电子才能配对成键,所以共价键有饱和性;另外, 原子轨道互相重叠时,必须满足对称条件和最大重叠条件,所以共价键有方向性。共价键又可分为三种:
1.非 极性共价键形成共价键的电子云正好位于键合的试应香复村兰织跑迫烟两个原子正中间,如金刚石的C-C键。
2.极性共价键 形成共价键的电子云偏于对电子引力较大的一个原子,如Pb-S 键,电子云偏于S一侧青停社普乐以交,可表示为Pb→S。
3.配价键 共享的电子对只有一个原子单独提供。如Zn-S键,共享的电子对由锌提供,Z:+ ¨..S:=Z n→S 共价键可以形成两类晶体,即 原子晶体共价键与 分子晶体。 原子晶体的晶格结点上排列着原子。原状从青建岩规青金子之间有共价键联系着。在分子晶体的 晶格结点上排列着分子(极性分子或非极责八开门饭滑计排口额液性分子),在分子之间有分子间力作用着,在某些晶体中还存在着 氢键。
 离子间的反应离子间的反应
离子间的反应离子间的反应
凝固成 液氯、 液氨和 干冰( 二氧化碳的晶体)营增很跑喜律似讲品值门。说明在分子之间还有一种 作用力存在着,这种作用力叫做分子间力(范德华力),有的叫 分子键。分子间力的分子的 极性有关。分子有极性分子和非极性分子,其根据是分子中的正负电荷中心是否重合,重合者为工下极状践修占油非极性分子,不重合者为极性分子。 分子间力包括三种作用力,即 色散力、诱导力和 取向力。
(1)当非极性分子相互靠近时,由于电子的不断运动和原植端静谁杆既总激往吗货子核的不断振动,要使每乡马巴促促一瞬间正、负电荷中心都重合是不可能的,在某一瞬间总会有一个偶极存在,这种偶极叫做瞬时偶极。由于同极相斥,异极相吸,瞬时偶极之间产生的分子间力叫做 色散力。任何分子(不论极性或非极性)互相靠近时,都存在色散力。
(2)当极性分子和 非极性分子靠近时,除了存在色散力作用外,由于非极性分子受极性分子电场的影响产生诱导偶极,这种诱导偶极和极性分子的固有偶极之间所产生的吸引力叫做诱导力。同时诱导偶极又作用于极性分子,使其偶极长度增加。从而进一步加强了它们间的吸引。
(3)当 极性分子相互靠近时,色散力也起着作用。此外,由于它们之间固有偶极之间的同极相斥,异极相吸,两个分子在空间就按异极相邻的状态取向,由于固有偶极之间的取向而引起的分子间力叫做 取向力。由于取向力的存在,使极性分子更加靠近,在相邻分子的固有偶极作用下,使每个分子的正、负电荷中心更加分开,产生了诱导偶极,因此极性分子之间还存在着诱导力。
总之,在非极性分子之间只存在着色散力,在极性分子和非极性分子之间存在着色散务和诱导力,在极性分子之间存在着色散力、诱导力和取向力。色散力、诱导力和 取向力的总和叫做分子间力。分子间力没有方向性与饱和性,键力较弱。
折叠 编辑本段 特征
离子是组成离子型化合物的基本粒子。离子型化合物在任何状态下(晶体、熔融状态、蒸气状态或溶液中)都是以离子的形式存在的。因此,离子的性质在很大程度上决定着离子化合物的性质。就是说,离子的性质,即离子的三种重要特征:离子的电荷、离子的半径、离子的电子层结构的类型(简称离子的 电子构型)是决定离子型化合物的共性和特性的根本原因。
(1)离子的电荷
离子 电荷对于离子的性质以及所组成的离子型 化合物的性质,都有很大影响。即使是同一种元素,当形成不同电荷的离子时,由它们所组成的离子型化合物的性质也会有较大的差异。例如,铁元素能形成Fe、Fe两种离子,这两种离子及其化合物在性质上就大不相同。Fe比Fe的正电荷多,在一定条件下,Fe能夺取1个电子变成Fe,而相反,Fe则有失去1个电子变为Fe的倾向。Fe在溶液中能跟SCN离子作用生成血红色的Fe(SCN)离子,而Fe则不发生这种反应;Fe在 水溶液里呈黄色,Fe在水溶液里却呈浅绿色等。
(2)离子的电子构型
离子的电子层结构类型不同,对离子化合物的性质亦有一定的影响,例如,Na和Cu离子的电荷数相同,都是+1价的离子,它们的离子半径也很相近,Na的半径是0.095 nm,Cu的半径是0.096 nm,但它们相应的化合物的性质却有较大的差别:如NaI易溶于水,而CuI不易溶于水。这主要是由于Na的 电子构型(2sp)和Cu的电子构型(3spd)很不相同。
(3)离子的半径
原子或离子的绝对大小是无法确定的,因为原子核外电子并非在固定的轨道上运动。而通常说的 离子半径是指离子的有效半径,它是通过各种结构分析实验测定两个异号离子A和B所组成的离子型化合物的核间距d求算出来的。而d等于A的半径r1与B的半径r2之和,即
d=r1+r2
由此可见,离子半径只能近似地反映离子的大小,离子半径随配位数、离子的价数等等而改变。
离子半径求算时,必须假设某个离子的r1为已知,然后依据r2=d-r1公式求出r2。1926年,戈尔德施米特由晶体结构数据确定了氟离子和氧离子的半径分别是0.133 nm和0.132 nm,然后以此为基准,一一推算出其他各离子的半径。
定义一:描述离子大小的参数。取决于 离子所带电荷、 电子分布和晶体结构型式
离子半径  离子半径电荷、电子分布和 晶体结构型式。设r阳为阳 离子半径,r阴为阴离子半径。r阳+r阴= 键长。r阳/r阴与晶体类型有关。可从 键长计算离子半径。一般采用Goldschmidt半径和Pauling半径,皆是NaCl型结构 配位数为6的数据。Shannon考虑了配位数和 电子自旋状态的影响,得到两套最新数据,其中一套数据,参考电子云密度图,阳离子半径比传统数据大14pm,阴离子小14pm,更接近晶体实际。 定义二:反映离子大小的一个物理量。离子可近似视为球体, 离子半径的导出以正、 负离子半径之和等于离子键 键长这一 原理为基础,从大量X射线 晶体结构分析实测键长值中推引出离子半径。 离子半径的大小主要取决于离子所带电荷和离子本身的 电子分布,但还要受离子化合物结构型式(如 配位数等)的影响,离子半径一般以配位数为6的氯化钠型晶体为基准,配位数为8时,半径值约增加3% ;配位数为4时,半径值下降约5%。负离子半径一般较大,约为1.3~2.5埃;正离子半径较小,约为0.1~1.7埃。根据正、负离子半径值可导出正、 负离子的半径和及 半径比,这是阐明 离子化合物 性能和 结构型式的两项重要因素。
离子半径电荷、电子分布和 晶体结构型式。设r阳为阳 离子半径,r阴为阴离子半径。r阳+r阴= 键长。r阳/r阴与晶体类型有关。可从 键长计算离子半径。一般采用Goldschmidt半径和Pauling半径,皆是NaCl型结构 配位数为6的数据。Shannon考虑了配位数和 电子自旋状态的影响,得到两套最新数据,其中一套数据,参考电子云密度图,阳离子半径比传统数据大14pm,阴离子小14pm,更接近晶体实际。 定义二:反映离子大小的一个物理量。离子可近似视为球体, 离子半径的导出以正、 负离子半径之和等于离子键 键长这一 原理为基础,从大量X射线 晶体结构分析实测键长值中推引出离子半径。 离子半径的大小主要取决于离子所带电荷和离子本身的 电子分布,但还要受离子化合物结构型式(如 配位数等)的影响,离子半径一般以配位数为6的氯化钠型晶体为基准,配位数为8时,半径值约增加3% ;配位数为4时,半径值下降约5%。负离子半径一般较大,约为1.3~2.5埃;正离子半径较小,约为0.1~1.7埃。根据正、负离子半径值可导出正、 负离子的半径和及 半径比,这是阐明 离子化合物 性能和 结构型式的两项重要因素。
折叠 编辑本段 常见离子
折叠 阳离子
1.简单阳离子
铝离子 | Al³+ | |
| 钡离子 | Ba²+ | |
铍离子 | Be²+ | |
铯 离子 | Cs+ | |
钙离子 | Ca²+ | |
铬离子(II) | Cr²+ | |
铬离子(III) | Cr³+ | |
铬离子(VI) | Cr6+ | |
钴离子(II) | Co²+ | |
钴离子(III) | Co³+ | |
亚铜离子(I) | Cu+ | |
铜离子(II) | Cu²+ | |
镓 离子 | Ga³+ | |
氦离子 | He | α个子 |
氢离子 | H+ | 质子 |
亚铁离子(II) | Fe²+ | |
铁离子(III) | Fe³+ | |
铅离子(II) | Pb²+ | |
铅离子(IV) | Pb4+ | |
锂离子 | Li+ | |
镁离子 | Mg²+ | |
锰离子(II) | Mn²+ | |
锰离子(III) | Mn³+ | |
锰离子(IV) | Mn4+ | |
锰离子(VII) | Mn7+ | |
汞离子(II) | Hg²+ | |
亚镍离子(II) | Ni²+ | |
镍离子(III) | Ni³+ | |
钾 离子 | K+ | |
银 离子 | Ag+ | |
钠离子 | Na+ | |
锶离子 | Sr²+ | |
亚锡离子(II) | Sn²+ | |
锡离子(IV) | Sn4+ | |
金离子 | Au²+ | |
锌 离子 | Zn²+ |
2.多原子阳离子
铵根离子 | NH₄+ |
水合氢离子 | H₃O+ |
硝鎓离子 | NO₂ˉ |
亚汞(I) | Hg+ |
折叠 阴离子
1.简单阴离子
名称 | 化学式 | 合称 |
|---|---|---|
砷离子 | As³+ | 砷化物 |
| 叠氮根离子 | N³ˉ | 叠氮化物 |
溴离子 | Brˉ | 溴化物 |
氯离子 | Clˉ | 氯化物 |
氟离子 | Fˉ | 氟化物 |
氢负离子 | Hˉ | 氢化物 |
碘离子 | Iˉ | 碘化物 |
氮离子 | N³ˉ | 氮化物 |
氧离子 | O²ˉ | 氧化物 |
磷离子 | P5ˉ | 磷化物 |
硫离子 | S²ˉ | 硫化物 |
过氧根离子 | O₂²ˉ | 过氧化物 |
2. 含氧酸根
名称 | 化学式 | 合称 |
|---|---|---|
砷酸根离子 | AsO₄³ˉ | 砷酸盐 |
| 亚砷酸根离子 | AsO₃³ˉ | 亚砷酸盐 |
硼酸根离子 | BO₃ˉ | 硼酸盐 |
溴酸根离子 | BrO₃ˉ | 溴酸盐 |
次溴酸根离子 | BrOˉ | 次溴酸盐 |
碳酸根离子 | CO₃²ˉ | 碳酸盐 |
碳酸氢根离子 | HCO₃ˉ | 碳酸氢盐 |
氢氧根离子 | OHˉ | 氢氧化物 |
氯酸根离子 | ClO₃ˉ | 氯酸盐 |
高氯酸根离子 | ClO₄ˉ | 高氯酸盐 |
亚氯酸根离子 | ClO₂ˉ | 亚氯酸盐 |
次氯酸根离子 | ClOˉ | 次氯酸盐 |
铬酸根离子 | CrO₄²ˉ | 铬酸盐 |
重铬酸根离子 | Cr₂O₇²ˉ | 重铬酸盐 |
碘酸根离子 | IO₃ˉ | 碘酸盐 |
硝酸根离子 | NO₃ˉ | 硝酸盐 |
亚硝酸根离子 | NO₂ˉ | 亚硝酸盐 |
磷酸根离子 | PO4ˉ | 磷酸盐 |
亚磷酸根离子 | HPO₃ˉ | 亚磷酸盐 |
磷酸一氢根离子 | HPO₄ˉ | 磷酸一氢盐 |
磷酸二氢根离子 | H₂PO₄ˉ | 磷酸二氢盐 |
锰酸根离子 | MnO₄²ˉ | 锰酸盐 |
高锰酸根离子 | MnO₄ˉ | 高锰酸盐 |
硫酸根离子 | SO₄²ˉ | 硫酸盐 |
硫代硫酸根离子 | S₂O₃²ˉ | 硫代硫酸盐 |
硫酸氢根离子 | HSO₄ˉ | 硫酸氢盐 |
亚硫酸根离子 | SO₃²ˉ | 亚硫酸盐 |
亚硫酸氢根离子 | HSO₃ˉ | 亚硫酸氢盐 |
过硫酸根离子 | S₂O8²ˉ | 过硫酸盐 |
硅酸根离子 | SiO₄²ˉ | 硅酸盐 |
偏硅酸根离子 | SiO₃²ˉ | 偏硅酸盐 |
铝硅酸根离子 | AlSiO₄ˉ | 铝硅酸盐 |
3. 有机酸根离子
名称 | 化学式 | 合称 |
|---|---|---|
乙酸根(醋酸根)离子 | CH₃COOˉ | 乙酸盐 |
| 甲酸根离子 | HCOOˉ | 甲酸盐 |
草酸根离子 | (COO)²ˉ 或 C₂O₄²ˉ | 草酸盐 |
草酸氢根离子 | HOOCCOOˉ 或 HC₂O₄ˉ | 草酸氢盐 |
4. 其他阴离子
名称 | 化学式 | 合称 |
|---|---|---|
硫化氢根离子 | HSˉ | 硫化氢盐 |
| 碲离子 | Te²ˉ | 碲化物 |
氨基负离子 | NH₂ˉ | 氨基盐 |
氰酸根离子 | OCNˉ | 氰酸盐 |
硫氰酸根离子 | SCNˉ | 硫氰酸盐 |
氰离子 | CNˉ | 氰化物 |
折叠 常见颜色
名称 | 化学式 | 颜色 |
|---|---|---|
高锰酸根离子 | MnO₄ˉ | 紫色 |
| 锰酸根离子 | MnO₄²ˉ | 绿色 |
铬酸根离子 | CrO₄²ˉ | 黄色 |
重铬酸根离子 | Cr₂O₇²ˉ | 橙色 |
铜离子 | Cu²+ | 蓝色 |
亚铜离子 | Cu+ | 红色 |
铁离子 | Fe²+ | 黄色 |
亚铁离子 | Fe³+ | 淡绿色 |
亚钴离子 | Co+ | 粉红色 |
锰离子 | Mn²+ | 淡粉红色 |
溴离子 | Brˉ | 淡黄色 |
折叠 编辑本段 离子方程式
用实际参加反应的 离子符号表示离子反应的式子。它不仅表示一定物质间的某个反应,而且表示了所有同一类型的离子反应的基本步骤为:
①、写出有关反应的 化学方程式。
②、可溶性的强 电解质(强酸、强碱、可溶性盐)用离子符号表示,其它难溶的物质、 气体、水等仍用分子式表示。微溶的强电解质应看其是否主要以自由离子形式存在,例如,石灰水中的Ca(OH)₂写离子符号,石灰乳中的Ca(OH)₂用分子式表示。
③、删去方程式两边不参加反应的离子。
④、检查式子两边的各种原子的个数及电荷数是否相等。
各种类型的离子方程式可按下列方法书写:
①、珞和反应、盐类的水解反应应直接写离子方程式。例如,氯化铁溶液跟硫氰化钾溶液反应:Fe³+ + SCNˉ===Fe(SCN)₃
碳酸钠水解:Ⅰ. CO₃²ˉ+H₂O===HCO₃ˉ+OHˉ Ⅱ . HCO₃ˉ+H₂O===H₂CO₃+OHˉ
②、简单的复分解反应可直接写出离子方程式。注意:当反应物一边或生成物一边有多种物质需用分子式表示时,应当写全,不可遗漏。例如,氢氧化钡与硫酸铵溶液共热:可溶性酸式盐跟强碱的反应比较复杂,应按基本步骤书写,否则易出错误。
③、 氧化还原类型的离子反应应按基本步骤书写,否则会出现多种错误。例如,铁跟氯化铁溶液反应,以下写法是错误的(两边电荷不等):Fe+Fe=2Fe, 应先写出化学方程式: Fe+2FeCl₃===3FeCl₂,再删去未反应的Cl:Fe+2Fe³+===3Fe²+
折叠 编辑本段 毒性
离子液体(ILs)是完全由离子组成的在室温或使用温度下呈液态的盐,一般由较大的有机阳离子和较小的无机阴离子组成。离子液体的物化性质以及应用方面已有较多报道,但有关离子液体的负面影响直到最近才引起人们的注意。有报道指出:离子液体因没有蒸气压,在使用过程中本身不会形成挥发性有机物而被称为"绿色产品",但离子液体本身并非"绿色"产品---某些离子液体甚至是有毒的。Jastorff等则指出离子液体在设计应用方面存在一定的危害,并提出应结合多学科知识对其潜在危害性进行综合评价。从离子液体的制备、再生和处置过程看:目前用于制备离子液体的主要原料(烷基取代咪唑、烷基取代吡啶、烷基取代盐和烷基取代铵盐等)大多是挥发性有机物;而离子液体的再生过程主要是采用具有挥发性的传统有机溶剂进行萃取的过程;某些离子液体本身是有毒且难以生物降解的。因此,在离子液体大规模应用前需对其应用风险进行评价。
离子液体的毒性在其对生态环境的影响与应用风险评价方面起着极其重要的作用。近年来有关离子液体毒性方面的研究却远远滞后于离子液体物性及应用研究,直到最近才有少量报道。
折叠 编辑本段 毒性研究
离子液体毒性的相关研究,国外处于起步阶段,国内尚未见相关报道。从已有研究报道看,目前的研究工作主要集中在以下两个问题:一是ILs对生态系统中各类生物的毒性作用情况;二是ILs的各部分组成对ILs毒性的影响。ILs各组成部分对其毒性的影响主要包括如下方面: (1)阳离子核对ILs毒性的影响;(2)侧链取代基R1、R2的长度对ILs毒性的影响;(3)阴离子对ILs毒性的影响。研究方法以生物个体水平的毒性试验研究为主,并有少量分子、细胞水平的毒性试验以及SAR研究。